第四章 固体火箭发动机燃烧室的热力计算
固体火箭发动机的热力计算是发动机设计工作中的基本计算之一,它为发动机设计提供原始数据。
固体火箭发动机的热力计算由两部分组成:燃烧室中燃烧过程的热力计算和喷管中流动过程的热力计算。本章详细阐述燃烧室热力计算的原则和方法,喷管中的热力计算问题在下一章中介绍。
§4.1 燃烧室热力计算的理论基础
由于在固体推进剂中含有多种(可以多达十几种)化学元素,并且燃烧温度较高,因此它的燃烧产物一般处于离解状态。这些情况使得固体推进剂燃烧产物的成分复杂,种类繁多,可能包含几十种,甚至更多种类的物质。对于这样复杂的热力学系统,需要有专门的方法进行热力计算。
一、发动机热力计算的任务
固体火箭发动机热力计算的任务是,在给定推进剂配方、初温、燃烧室压强和喷管出口截面压强的条件下,计算:
1.燃烧室中燃烧产物的成分、绝热燃烧温度及其热力学性质和输运性质,以及推进剂的理论特征速度;
2.喷管出口截面上(或其它指定的喷管截面上)燃烧产物的成分、温度及其热力学性质,并在此基础上计算发动机的理论比冲。
燃烧产物的热力学性质是指燃烧产物的定压比热、定容比热、比热比和声速等。燃烧产物的输运性质是指气体的粘性系数和热传导系数。
固体火箭发动机的计算工作往往从热力计算开始,它为内弹道计算、喷管内流场计算以及传热计算等提供必要的数据。
二、燃烧室热力计算的理论模型
在燃烧室的热力计算中通常采用如下假设:
1.固体推进剂的燃烧过程是绝热的,燃烧产物与外界没有热交换,燃烧所释放的热量全部被燃烧产物吸收。
2.固体推进剂的燃烧产物处于化学平衡状态。
3.燃烧产物中的每种单质气体及由它们混合而成的气体都认为是完全气体,它们都符合完全气体的状态方程。
在上述假设基础上,建立了固体推进剂燃烧过程的绝热—-化学平衡模型,其特点是
\({{\tilde{I}}_{m}}={{\tilde{I}}_{p}}\) (4-1)
式中 \({{\tilde{I}}_{m}}\)——1kg质量燃烧产物的总焓,单位为kJ/kg;
\({{\tilde{I}}_{p}}\)——1kg质量推进剂的总焓,单位为kJ/kg。
燃烧室热力计算的内容大体上可分为三个部分:一是固体推进剂的假定化学式与总焓(化学能与焓之和)的计算;二是根据质量守恒方程和化学平衡方程,在给定压强和指定温度的条件下计算处于化学平衡状态的燃烧产物的成分(简称平衡组分);三是在给定压强条件下根据能量守恒方程确定燃烧温度,然后求出该温度下燃烧产物的平衡组分及其热力学性质和输运性质,并计算推进剂的理论特征速度。在上述计算中,燃烧产物平衡组分的计算是中心环节,计算工作量也最大,是本章重点介绍的内容。
燃烧过程的绝热—-化学平衡模型是一种理想化的情况,它与实际过程之间存在着一定的偏离。因此为了确定燃烧过程的实际参数,需要对理论计算结果进行必要的修正。
三、推进剂总焓
物质的总焓反映了物质具有的总能量。在不同的能量转换过程中,总焓概念具有不同的内容,因为本章讨论的是具有化学反应的系统,因此物质的总焓定义为物质的化学能和物质的焓H之和:
I=X+H (4-2)
式中I、X、H的单位为kJ/mol。
物质在温度T时的焓可用下式表示
\(H=\int_{\,0}^{\,T}{{{c}_{p}}\text{d}T}\) (4-3)
式中 cp——物质的定压比热,单位为kJ/mol·K。
化学能是潜藏在物质内部的能量,仅在化学反应时才被释放出来。化学能的大小仅取决于物质的结构,它与外界的温度及压强无关。对于热力计算来说,重要的是化学能的变化,而不是其绝对值。如果经过化学反应以后,生成物的化学能小于反应物的化学能,则在化学反应过程中,这两种物质的化学能的差值就要以热能的形式被释放出来。通常,物质的化学能通过其标准生成焓来表示,所以为了表示物质的化学能,需要找到化学能与标准生成焓之间的关系。物质的标准生成焓可以由试验测得,也可以经计算得到。
物质的标准生成焓\(H_{f}^{{{T}_{s}}}\)是在基准压强(取为1个物理大气压)和基准温度Ts(通常取为298.16K或293.16K)下,由标准元素生成1mol该物质时所吸收或放出的热量。它与物质的生成热的数值相等,但符号相反,即吸热取为正值,放热取为负值。所谓标准元素就是在自然界中处于稳定的和最常见状态下的单质,如H2、O2、N2、固态C(石墨)、金属Al等。
物质的标准生成焓\(H_{f}^{{{T}_{s}}}\)等于物质的基准温度Ts下的总焓(以下简称为基准总焓)\({{I}^{{{T}_{s}}}}\)与生成该物质的标准元素在基准温度Ts下的总焓\(H_{f}^{{{T}_{s}}}={{I}^{{{T}_{s}}}}-I_{st}^{{{T}_{s}}}\)之差,即
\(H_{f}^{{{T}_{s}}}={{I}^{{{T}_{s}}}}-I_{st}^{{{T}_{s}}}\)
利用式(4-2)和(4-3),上式可写为
\(H_{f}^{{{T}_{s}}}=\left( X+\int_{\ 0}^{\ {{T}_{s}}}{{{c}_{p}}\text{d}T} \right)-\left( {{X}_{st}}+\int_{\ 0}^{\ {{T}_{s}}}{{{c}_{p,\ st}}\text{d}T} \right)\) (4-4)
式中 下角标“st”表示属于标准元素。在热力计算中,重要的不是物质的化学能和焓的绝对值,而是它们的变化量,所以用于计算的基准,原则上可以任意取定,只要在整个计算中采用同一个基准,就不会影响化学能和焓的变化量的计算值。为了计算方便,通常规定:标准元素的化学能和其在基准温度下的焓值取为零,即
\({{X}_{st}}=0\)
\(\int_{\ 0}^{\ {{T}_{s}}}{{{c}_{p,\ st}}\text{d}T=0}\) (4-5)
也就是说,在基准温度下标准元素的总焓取为零值,于是由式(4-4)得到
\(H_{f}^{\ {{T}_{s}}}=X+\int_{\ 0}^{\ {{T}_{s}}}{{{c}_{p}}\text{d}T={{I}^{\ {{T}_{s}}}}}\) (4-6)
上式说明物质的标准生成焓\(H_{f}^{{{T}_{s}}}\)等于该物质的化学能加上该质物在基准温度下的焓。有了上述关系式,物质的化学能就可用该物质的标准生成焓来表示。由式(4-6)可以看出,物质的化学能等于该物质在绝对零度时的生成焓,即
\(X=H_{f}^{0}\) (4-7)
由式(4-6)还可以看出,物质的标准生成焓\(H_{f}^{{{T}_{s}}}\)等于该物质的基准总焓\({{I}^{{{T}_{s}}}}\)。对于标准元素来说,其基准总焓\(I_{st}^{Ts}\)及标准生成焓\(H_{f\cdot st}^{Ts}\)都等于零。
将式(4-3)和(4-6)代入式(4-2),可得到任意温度下物质总焓的表达式:
\(I=H_{f}^{0}+\int_{\ 0}^{\ T}{{{c}_{p}}\text{d}T}=H_{f}^{\ {{T}_{s}}}+\int_{\ {{T}_{s}}}^{\ T}{{{c}_{p}}\text{d}T}\) (4-8)
物质的标准生成焓\(H_{f}^{{{T}_{s}}}\),可在有关物理化学或化学热力学的手册中查到。在热力计算中常用到的某些物质的标准生成焓\(H_{f}^{298}\)列于附录4-2中。
固体推进剂由多种组元组成,所以1kg质量推进剂的总焓\({{\tilde{I}}_{p}}\)等于其中各组元的总焓之和。若已知固体推进剂的组成,并且不考虑在推进剂混合、固化过程中的热效应,则1kg质量固体推进剂的总焓可由下式计算:
\({{\tilde{I}}_{p}}=\sum\limits_{i=1}^{K}{{{{\tilde{I}}}_{i}}{{q}_{i}}}\) (4-9)
式中 qi——固体推进剂中第种组元的质量百分数;
\({{\tilde{I}}_{i}}\)——1kg质量第种组元的总焓(kJ/kg);
K——组成固体推进剂的组元数。
1moli组元的总焓Ii值按照式(4-8)计算,然后通过单位之间的换算,计算\({{\tilde{I}}_{i}}\)值。液体或固体物质的比热,无定压或定容条件之分,都用符号c表示。在常用的温度范围内,可认为比热c与温度无关,故计算1mol固体推进剂组元的总焓Ii的公式可写为
\({{I}_{i}}=H_{f,i}^{{{T}_{s}}}+{{c}_{i}}({{T}_{i}}-{{T}_{s}})\) (4-10)
式中Ti体推进剂的初温。
在查用热力学性质数据表时,应该注意单位之间的换算。例如
\({{\tilde{I}}_{i}}\)(kJ/kg)\(={{I}_{i}}\)(kJ/mol)1000/mi (4-11)
式中 mi第i组元的摩尔质量
[例4-1] 已知某聚硫复合固体推进剂的组成,其中各组元的质量百分数:过氯酸铵67.5%;聚硫橡胶22.0%;苯乙烯5.8%;铝粉3.0%;环氧树脂1.7%。计算该推进剂在初温\({{T}_{i}}=298.16\) K条件下的总焓。
解:因为固体推进剂的初温等于基准温度Ts以由式(4-10)可得
\({{I}_{i}}=H_{f,i}^{{{T}_{s}}}\)
推进剂各组元的标准生成焓由附录4-2中查得。
1kg固体推进剂的总焓,根据式(4-9)列表计算如下。
表4-1 某聚硫推进剂的总焓计算
| 组元
编号 |
推进剂组元 | 质量百分数qi% | 分子量mi | 1mol组元的总焓Ii/mol | 1kg组元的总焓
\(\tilde{I}_{i}\)/kg |
1kg推进剂中各组元的总焓
kJ/kg |
| 1
2 3 4 5 |
过氯酸铵
聚硫橡胶 苯乙烯 铝粉 环氧树脂 |
67.5
22.0 5.8 3.0 1.7 |
117.5
1000 104 26.98 1000 |
-290.564
1060.935 1103.414 0 -1436.072 |
-2483.772
1060.935 994.365 0 -1436.072 |
-1676.546
233.406 57.673 0 -24.413 |
| 1kg固体推进剂的总焓\({{\tilde{I}}_{p}}=\sum\limits_{i=1}^{K}{{{{\tilde{I}}}_{i}}{{q}_{i}}=-\text{1409}\text{.88}}\)kJ | ||||||
四、固体推进剂的假定化学式
计算固体推进剂的假定化学式是为了得到1kg固体推进剂中含有各有关化学元素的摩尔数,便于建立推进剂燃烧前后的质量守恒方程。
固体推进剂通常由几种化学物质组成,如表4-2中所列的某聚硫复合推进剂由5种物质组成。
表4-2 某聚硫复合推进剂的组成
| 组 元 | 质量百分数gi | 组元的化学式或各元素在组元中的质量百分数 | |
| 1 | 过氯酸铵 | 71.5% | NH4ClO4 |
| 2 | 聚硫橡胶 | 20.5% | C-35.89%;H-6.10%
O-20.28%;S-37.73% |
| 3 | 苯 乙 烯 | 4.0% | C8H8 |
| 4 | 铝 粉 | 2.5% | Al |
| 5 | 环氧树脂 | 1.5% | C-72.94%; H-7.02; O-20.04% |
组成固体推进剂的每种物质称为组元。由表4-2可见,此种推进剂由过氯酸铵、聚硫橡胶等五种组元组成,而每个组元又由若干化学元素组成。由质量守恒定律可知,经过化学反应后(例如燃烧)固体推进剂中各元素的原子数(或原子摩尔数)保持不变。因此为了便于应用质量守恒定律,可将固体推进剂看作是一种假想的由基本化学元素组成的单一化学物质,其化学式叫做固体推进剂的假定化学式。在热力计算中,采用1kg质量的推进剂作为计算单位,因此规定固体推进剂的假定化学式也以1kg质量为单位,即它的假定摩尔质量为1000g/mol。
固体推进剂的假定化学式的一般形式可写为
\({{\text{C}}_{{{\text{N}}_{\text{C}}}}}{{\text{H}}_{{{\text{N}}_{\text{H}}}}}{{\text{O}}_{{{\text{N}}_{\text{O}}}}}{{\text{N}}_{{{\text{N}}_{\text{N}}}}}\cdots \) (4-12)
式中 下角标Nc、NH、NO、NN…表示1kg质量的固体推进剂中含有C、H、O、N…等元素的原子摩尔数。所以假定化学式不表示固体推进剂的化学结构,只表示含有各元素的组成。
确定固体推进剂假定化学式的步骤如下:
1.计算1kg组元的假定化学式
若组元的分子式已知,则首先将组元的分子式写成一般化学式以表示该组元所含元素的情况。例如硝化甘油的分子式为C3H5(ONO2)3,可将它改写为按元素C、H、O、N次序排列的一般化学式,其形式为C3H5O9N3。组元的一般化学式表示了1mol组元中含有各化学元素的原子摩尔数,例如1mol硝化甘油中含有C元素的三个原子摩尔数、H元素的五个原子摩尔数、O元素的九个原子摩尔数、N元素的三个原子摩尔数。因此,1mol组元的一般化学式的通式可以写为
CCHHOONN (4-13)
现在讨论1kg组元的假定化学式,其通式写为
\({{\text{C}}_{{\text{{C}’}}}}{{\text{H}}_{{\text{{H}’}}}}{{\text{O}}_{{\text{{O}’}}}}{{\text{N}}_{{\text{{N}’}}}}\cdots \) (4-14)
在式(4-13)和(4-14)中,下角标C、H、O、N…为1mol组元中含有相应各元素的原子摩尔数;下角标C'、H'、O'、N'、…为1kg组元中含有相应各元素的原子摩尔数。二者之间显然存在如下关系:
\({C}’=\frac{\text{1000}}{\text{m}}C \)
\( {H}’=\frac{1000}{m}H \)
\( {O}’=\frac{1000}{m}O \)
\( {N}’=\frac{1000}{m}N \)
(4-15)
式中 m——该组元的摩尔质量。
在有些情况下,若组元中各元素的质量百分数已知,则1kg组元中含有各相应元素的原子摩尔数也可按下式确定:
\( {C}’=\frac{1000}{{{m}_{C}}}{{g}_{C}} \)
\({H}’=\frac{1000}{{{m}_{H}}}{{g}_{H}} \)
\({O}’=\frac{1000}{{{m}_{O}}}{{g}_{O}} \)
\({N}’=\frac{1000}{{{m}_{N}}}{{g}_{N}}\)
(4-16)
式中 mC、mH、mO、mN——元素C、H、O、N的原子摩尔质量;
gC、gH、gO、gN——组元中元素C、H、O、N的质量百分数。
例如:已知环氧树脂中各元素的质量百分数为gC——72.94%;gH——7.02%;gO——20.04%。则按式(4-16)可得
\({C}’=\frac{1000}{12}\times \text{72}\text{.94 }\!\!%\!\!\text{ }=\text{60}\text{.78}\)
\({H}’=\frac{1000}{1}\times \text{7}\text{.02 }\!\!%\!\!\text{ }=\text{79}\text{.20}\)
\({O}’=\frac{1000}{16}\times \text{20}\text{.04 }\!\!%\!\!\text{ }=\text{12}\text{.53}\)
由此得出1kg环氧树脂的假定化学式为
\({{\text{C}}_{\text{60}\text{.78}}}{{\text{H}}_{\text{70}\text{.20}}}{{\text{O}}_{\text{12}\text{.53}}}\)
2.计算1kg推进剂的假定化学式
假定固体推进剂中含有K种组元,各组元在推进剂中的质量百分数分别为\({{q}_{1}}{{q}_{2}}\cdots \cdots {{q}_{K}}\),则
\({{N}_{C}}=\sum\limits_{i=1}^{k}{{{q}_{i}}{C}_{i}^{{‘}}} \)
\({{N}_{H}}=\sum\limits_{i=1}^{k}{{{q}_{i}}{H}_{i}^{{‘}}} \)
\({{N}_{O}}=\sum\limits_{i=1}^{k}{{{q}_{i}}{O}_{i}^{{‘}}} \)
\({{N}_{N}}=\sum\limits_{i=1}^{k}{{{q}_{i}}{N}_{i}^{{‘}}} \)
\(\text{ }\ldots \ldots \)
(4-17)
式中 qi——推进剂中第种组元的质量百分数;
\({C}_{i}^{’}\)、\({H}_{i}^{{’}}、{O}_{i}^{{’}}、{N}_{i}^{{’}}\)——第种组元的C’、H’、O’、N’。
因为固体推进剂的假定化学式是对1kg质量的推进剂而言的,因此存在如下关系式:
\({{N}_{C}}{{m}_{C}}+{{N}_{H}}{{m}_{H}}+{{N}_{O}}{{m}_{O}}+{{N}_{N}}{{m}_{N}}+\cdots =1000\) (4-18)
在进行热力计算过程中,可用此式检验推进剂化学式的计算有无错误,若计算结果在规定的精度要求范围内,则认为计算无误。
【例4-2】已知某聚硫复合推进剂的组成如表4-2所示,确定该推进剂的假定化学式。
解:计算步骤如下:
1.计算各个组元的假定化学式
(1)过氯酸铵的假定化学式
过氯酸铵的摩尔质量为
\(m=14\times 1+1\times 4+35.5\times 1+16\times 4=117.5\)g/mol
由式(4-15)可得
\(C{l}’=\frac{1000}{117.5}\times 1=8.511\)
\({H}’=\frac{1000}{117.5}\times 4=34.043\)
\({O}’=\frac{1000}{117.5}\times 4=34.043\)
\({N}’=\frac{1000}{117.5}\times 1=8.511\)
因此,1kg过氯酸铵的假定化学式为
\({{\text{H}}_{\text{34}\text{.043}}}{{\text{O}}_{\text{34}\text{.043}}}{{\text{N}}_{\text{8}\text{.511}}}\text{C}{{\text{l}}_{\text{8}\text{.511}}}\)
(2)聚硫橡胶的假定化学式
1kg聚硫橡胶中各元素的原子摩尔数参照式(4-16)计算
\({C}’=\frac{1000}{{{m}_{C}}}{{g}_{C}}=\frac{1000}{12}\times 35.89%=29.908\)
\({H}’=\frac{1000}{{{m}_{H}}}{{g}_{H}}=\frac{1000}{1}\times 6.10%=61.0\)
\({O}’=\frac{1000}{{{m}_{O}}}{{g}_{O}}=\frac{1000}{16}\times 20.28%=12.675\)
\({S}’=\frac{1000}{{{m}_{S}}}{{g}_{S}}=\frac{1000}{32}\times 37.73%=11.791\)
因此,1kg聚硫橡胶的假定化学式为
\({{\text{C}}_{\text{29}\text{.908}}}{{\text{H}}_{\text{61}\text{.0}}}{{\text{O}}_{\text{12}\text{.675}}}{{\text{S}}_{\text{11}\text{.791}}}\)
同理可以求出其它组元的假定化学式,它们是:
苯乙烯 \({{\text{C}}_{76.923}}{{\text{H}}_{76.923}}\)
铝粉 \(\text{A}{{\text{l}}_{\text{37}\text{.037}}}\)
环氧树酯 \({{\text{C}}_{60.78}}{{\text{H}}_{70.20}}{{\text{O}}_{12.53}}\)
2.确定推进剂的假定化学式
根据求出的各组元的假定化学式,按照式(4-17)计算1kg推进剂中各元素的原子摩尔数。
\(NC=\sum\limits_{i=1}^{5}{{{q}_{i}}{C}_{i}^{‘}}=20.5%\times 29.908+4.0%\times 76.923+1.5%\times 60.78\text{ }\)
\(\text{ }=10.120 \)
\({{N}_{H}}=\sum\limits_{i=1}^{5}{{{q}_{i}}{H}_{i}^{‘}}=71.5%\times 34.043+20.5%\times 61.0+4.0%\times 76.923+1.5%\times 70.20\)
\(\ \quad \,=40.976\)
\({{N}_{O}}=\sum\limits_{i=1}^{5}{{{q}_{i}}{O}_{i}^{‘}}=71.5%\times 34.043+20.5%\times 12.675+1.5%\times 12.53\)
\(\quad \ =27.127\)
\({{N}_{N}}=\sum\limits_{i=1}^{5}{{{q}_{i}}N_{i}^{‘}}=71.5%\times 8.511=6.085\)
\({{N}_{Cl}}=\sum\limits_{i=1}^{5}{{{q}_{i}}(Cl{)}_{i}^{{‘}}}=71.5%\times 8.511=6.085\)
\({{N}_{S}}=\sum\limits_{i=1}^{5}{{{q}_{i}}(S{)}_{i}^{{‘}}}=20.5%\times 11.791=2.417\)
\({{N}_{Al}}=\sum\limits_{i=1}^{5}{{{q}_{i}}(Al{)}_{i}^{{‘}}}=2.5%\times 37.037=0.9259\)
因此,该聚硫复合推进剂的假定化学式为
\({{\text{C}}_{10.120}}{{\text{H}}_{40.976}}{{\text{O}}_{27.127}}{{\text{N}}_{\text{6}\text{.085}}}\text{C}{{\text{l}}_{\text{6}\text{.085}}}{{\text{S}}_{\text{2}\text{.417}}}\text{A}{{\text{l}}_{\text{0}\text{.9259}}}\)
3.验算
计算出的假定化学式是否正确,可利用式(4-18)进行验算。由式(4-18)得
\( 10.120\times 12+40.976\times 1+27.127\times 16+6.085\times 14+6.085\times 35.5+2.417\times 32 \)
\(\quad \quad +0.9259\times 27\text{ }=\text{999}\text{.9988} \)
计算结果与1000相近,相对误差只有0.0012%,表明整个计算无误。
§4.2 燃烧室热力计算的控制方程组
现取1kg质量的燃烧产物作为研究对象,把它看作是一个封闭的热力学系统。在此系统内含有多种化学元素,例如C、H、O、N、Cl、Al、…等,其总数用M表示。由于存在化学反应,系统内包含有数量众多的组分,例如CO2、CO、H2O、H2、H、…等,其总数用N表示。系统中的化学反应在给定压强和温度条件下,处于化学平衡状态。燃烧产物的成分一般用各组分的摩尔数或分压表示,也可以用相对摩尔数或质量分数表示。
在燃烧产物中有些物质可以以气相和凝相(液相或固相)两种状态同时存在。例如在燃烧产物中可能存在气态的Al2O3(g),同时也可能存在凝相的Al2O3(c)。在热力计算时,对于Al2O3(g)和Al2O3(c)虽是同一种化合物,但处于不同的物态,仍以两种不同的组分对待。
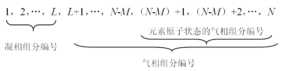
在热力计算时,为了方便起见,将燃烧产物中所包含的全部组分统一编号。本书采用的编号规则如下:
由上述编号规则可见,编号1~L为凝相组分编号,(L+1)~N为气相组分编号。在气相组分编号中,(L+1)~(N-M)为气相化合物的编号;(N-M+1)~N为气相原子组分的编号。在作具体计算时,哪些气相原子组分包含在燃烧产物内,哪些气相原子组分可以舍去,视具体情况而定。
固体火箭发动机热力计算的中心环节是计算给定压强和温度条件下燃烧产物的平衡组分。当固体推进剂的配方给定后,在给定压强和温度条件下计算燃烧产物平衡组分的控制方程为质量守恒方程和化学平衡方程,现介绍如下。
一、质量守恒方程
对于有化学反应的系统,其质量守恒方程应以元素的原子总数或原子摩尔总数写出。质量守恒定律表明:在固体推进剂燃烧前后,1kg质量推进剂中含有各元素的原子摩尔数,应等于1kg质量燃烧产物中所有组分内含有各相应元素的原子摩尔数的总和。
例如1kg质量推进剂中含有H元素为NH个原子摩尔数。NH值由计算固体推进剂假定化学式时得到。固体推进剂燃烧后,H元素分散在诸如H2O、H2、OH、H、HCl、…等燃烧产物的含H组分中,1mol的H2O和H2各含有2mol原子的H元素,1molHCl、OH、H中各含有1mol原子的H元素。因此,根据质量守恒定律可得如下关系式,即
\({{N}_{H}}=2{{n}_{{{H}_{2}}O}}+2{{n}_{{{H}_{2}}}}+{{n}_{HCl}}+{{n}_{OH}}+{{n}_{H}}\cdots \)
式中 \({{n}_{{{H}_{2}}O}}、{{n}_{{{H}_{2}}}}、{{n}_{HCl}}、{{n}_{OH}}、{{n}_{H}}\)为1kg质量燃烧产物中含有H2O、H2、HCl、OH、H的摩尔数。上式就是关于H元素的质量守恒方程。
同理,可以列出固体推进剂中其它元素的质量守恒方程,其通式可写为
\({{N}_{k}}=\sum\limits_{j=1}^{N}{{{A}_{kj}}{{n}_{j}}}\text{ }(k=1,2,\cdots ,M)\) (4-19)
式中 k——表示固体推进剂中含有的不同元素的编号;
Nk——1kg质量固体推进剂中含有第k元素的摩尔原子数,也就是说当k取不同值时,它分别代表NC、NH、NO、NN…的值;
nj——1kg燃烧产物中含有编号为j的组分的摩尔数;
Akj——1mol组分中含有k元素的摩尔原子数。
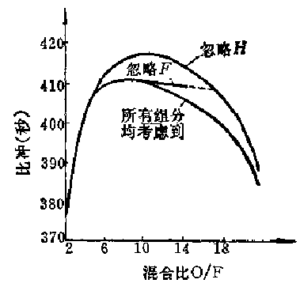
由式(4-19)可见,为了准确地建立质量守恒方程,除了必须计算出固体推进剂的假定化学式来确定Nk以外,还必须确定燃烧产物中所含组分的种类。这是对计算精度有重要影响的问题。原则上,应当把燃烧产物中可能存在的组分都包含在系统中。如果忽略了在燃烧产物中实际存在的任何重要成分,则对于计算结果会产生很大误差。为了对这个问题有一个具体概念,现以H2/F2配方为例进行说明。在H2/F2系统中,在它的燃烧产物中可能存在H、H2、F、F2和HF等组分,其中H和F都是主要组分,因为它们的浓度较大。如果在计算时忽略了F或者H的存在,则对于计算出的理论比冲就会带来较大误差,如图4-1所示。
图4-1 燃烧产物的组分确定不当时对H2/F2理论比冲的影响
(海平面比冲:\({{p}_{c}}=68.9476\times {{10}^{5}}\)Pa;平衡膨胀过程;完全膨胀。)
所以当计算一种新的固体推进剂时,应当把所有可能存在的组分都考虑进来。当然,系统中包含组分的种类越多,计算就越复杂。但经过多次计算就可能将浓度非常小的次要组分筛选掉。目前,对于大部分推进剂配方,已经可以根据经验有把握地确定其燃烧产物中的主要成分。例如,对于C、H、O、N系统,在燃烧产物中应包括CO2、H2O、CO、H2、O2、OH、H、O、O3、C、CH4、N2、N、NO、NH3等,其中主要的组分是CO2、H2O、CO、H2、N2、OH、O2、NO、H以及N、O。对于含有C、H、O、N、Al、Cl的固体推进剂,还必须包含更多的组分,这个问题在下一节中详细讨论。
在质量守恒方程(4-19)中,\({{n}_{j}}(j=1,2,\cdots ,N)\)是待求的未知量,共有N个,而方程组(4-19)中包含的方程仅有M个。为了求解nj,还缺少(N–M)个方程,缺少的方程由化学平衡方程提供。因为在固体推进剂的燃烧产物中,由于存在种元素的原子组分以及(N–M)种化合物组分,所以在系统内有多种可逆反应过程同时在进行。由化学热力学的一般理论可知,该系统内必有(N–M)种独立的可逆反应过程存在。对于每种独立的化学反应,可以写出一个独立的化学平衡方程,因而共有(N–M)个独立的化学平衡方程。
由质量定恒方程(M个)和化学平衡方程(N-M个)组成的方程组,是一个非线性的方程组,而且是包含超越方程在内的方程组,求解比较麻烦。为了求解此类方程组,人们已经研究出了多种方法。本章介绍其中三种方法,即计算平衡组分的化学平衡常数法(§4.3)、最小吉布斯自由能法(§4.4)以及布林克莱法(§4.5)。
二、化学平衡方程
当存在化学反应的系统处于热力学平衡状态时,意味着该系统处于下面三种平衡状态:
1.力学平衡。系统内部和系统与外界环境之间没有非平衡的力存在,称为达到力学平衡。
2.热平衡。系统内部和系统与外界环境之间都处于同一温度下,称为达到热平衡。
3.化学平衡。系统内各组分的摩尔数没有自发的变化趋势(不管多么缓慢),称为达到化学平衡。
现在着重讨论化学平衡问题。我们在研究化学平衡问题时首先肯定了系统是处于力学平衡和热平衡条件下的,因此认为系统是均匀的。正因为系统是均匀的,才能够利用宏观的热力学参数p和T来描述系统的状态,才能够用各组分的摩尔数nj来描述系统(固体推进剂燃烧产物)的成分。
为了不至于引起概念混淆,本章将表示反应平衡的化学反应表达式称为化学平衡式,而基于化学平衡式推导出的组分浓度关系式称为化学平衡方程。在可逆的化学反应中,正向反应与逆向反应是同时进行的,例如:
\(\text{C}{{\text{O}}_{\text{2}}}\leftrightarrow \text{CO}+\frac{\text{1}}{\text{2}}{{\text{O}}_{\text{2}}}-283.043 \)kJ/mol
在此反应中,一方面进行着CO2分解为CO和O2的正向反应,同时进行着CO与Q2化合成CO2的逆向反应。当正向反应速度与逆向反应速度相等时,系统内各组分(例如CO2、CO和O2)的浓度不再随时间而变化(不管多么缓慢),这种状态就是化学平衡状态。所以,当系统处于化学平衡状态时,系统中的化学反应不是停止了,而是正、逆两方向的反应以相等的速度在进行,因此化学平衡是动平衡。
在上面列举的反应中,正向反应是由三原子分子CO2分解为二原子分子CO和O2,这是一种离解反应。所谓离解反应就是原子数较多的分子分解为原子数较少的分子、原子团或单个原子。离解反应是吸热反应,它把一部分热能转变为离解产物的化学能。对于火箭发动机来说,本来希望推进剂的化学能在经过燃烧后尽可能多地转化为热能,而燃烧产物的离解却使推进剂在燃烧时可能释放出的热能部分地又转化为化学能,这就降低了燃烧过程中放出的热量,因而降低了发动机的性能。这种因燃烧产物离解作用所造成的发动机性能损失,称为离解损失。
离解反应的逆向反应,称为复合反应。复合反应把离解反应生成的原子数少的分子或单个原子,又重新化合为原子数较多的分子。例如在高温下离解的产物,当其温度下降时就会产生复合反应。与离解反应相反,复合反应是放热反应。
现在讨论描述化学平衡状态条件的化学平衡方程。
由热力学理论可知,热力学第二定律的数学分析式可写为:
\(\text{d}S\ge \frac{\text{d}Q}{T}\) (4-20)
式中,等号对应于可逆过程,不等号对应于不可逆过程。
如果系统对外界作的功只有容积功,则热力学第一定律的数学分析式可写为
\(\text{d}Q=\text{d}E+p\text{d}V\) (4-21)
此外,由吉布斯自由能的定义可得
\(G=H-TS=E+pV-TS\) (4-22)
将关系式(4-21)、(4-22)代入式(4-20)中,得到
\(\text{d}G+S\text{d}T-V\text{d}p\le 0\) (4-23)
式(4-23)是热力学第二定律数学分析式的另一种形式,式中等号对应于可逆过程,不等号对应于不可逆过程(自发过程)。在等温、等压条件下,即dT=0、dp=0的条件下,由式(4-23)可得
\(\text{d}G\le 0\) (4-24)
关系式(4-24)说明:在等温、等压条件下,只有使系统的自由能G减小的过程才能自发地进行。或者说,系统在等温、等压条件下进行自发过程时,系统的自由能G总是不断减小;当G减小到最小值Gmin时,系统的自由能就不能再减小了,这就意味着系统不可能再进行自发过程了(不管多么缓慢),这时系统处于平衡状态。换言之,在平衡状态下,系统的自由能保持为Gmin而不再变化,此时
G=Gmin (4-25)
或者
dG=0 (4-26)
由此可见,G=Gmin或者dG=0可作为等温、等压条件下系统达到平衡状态的判据。
对于存在有化学反应的系统(为简单起见,认为系统中只存在有一种化学反应),当系统的状态变化时,系统内部各组分的摩尔数也发生变化。这时,系统的自由能不仅是温度T和压强p的函数,而且是系统内各组分摩尔数nj的函数,即
\(G=G(T,p,{{n}_{1}},{{n}_{2}},\cdots ,{{n}_{k}})\) (4-27)
式中K为参加该化学反应的所有组分的总数。根据式(4-27),求函数G的全微分,得
\(\text{d}G={{\left( \frac{\partial G}{\partial T} \right)}_{p,{{n}_{1}},\cdots ,{{n}_{k}}}}\text{d}T+{{\left( \frac{\partial G}{\partial p} \right)}_{T,{{n}_{1}},\cdots ,{{n}_{k}}}}\text{d}p+\sum\limits_{j=1}^{k}{{{\left( \frac{\partial G}{\partial {{n}_{j}}} \right)}_{T,p,{{n}_{1}},\cdots ,{{n}_{j-1}},{{n}_{j+1}},\cdots ,{{n}_{k}}}}\text{d}{{n}_{j}}}\)(4-28)
由热力学可知
\({{\left( \frac{\partial G}{\partial T} \right)}_{p,{{n}_{1}},\cdots ,{{n}_{k}}}}=-S\)
\({{\left( \frac{\partial G}{\partial p} \right)}_{T,{{n}_{1}},\cdots ,{{n}_{k}}}}=V\) (4-29)
将式(4-29)代入式(4-28),得
\(\text{d}G=-S\text{d}T+V\text{d}p+\sum\limits_{j=1}^{k}{{{\left( \frac{\partial G}{\partial {{n}_{j}}} \right)}_{T,p,{{n}_{1}},\cdots ,{{n}_{j-1}},{{n}_{j+1}},\cdots ,{{n}_{k}}}}\text{d}{{n}_{j}}}\) (4-30)
引入符号μ,令
\({{\mu }_{j}}={{\left( \frac{\partial G}{\partial {{n}_{j}}} \right)}_{T,p,{{n}_{1}},\cdots ,{{n}_{j-1}},{{n}_{j+1}},\cdots ,{{n}_{k}}}}\) (4-31)
式中 μj表示在等温等压条件下,只变化j组分的摩尔数而保持其它组分的摩尔数不变时,第j组分增加1mol所引起系统自由能G的增量。μj称为j组分的化学位。
于是,可得到存在有化学反应的系统的热力学基本关系式
\(\text{d}G=-S\text{d}T+V\text{d}p+\sum\limits_{j=1}^{k}{{{\mu }_{j}}\text{d}{{n}_{j}}}\) (4-32)
由式(4-25)给出的判据可知,当系统在等温、等压条件下处于平衡状态时,必有dG=0。将这个条件代入式(4-32)。可得
\(\sum\limits_{j=1}^{k}{{{\mu }_{j}}\text{d}{{n}_{j}}}=0\) (4-33)
因此,对于具有不变温度和压强的封闭系统,处于化学平衡状态的条件就是式(4-33)。所以式(4-33)是描述等温、等压条件下,系统处于化学平衡状态的化学平衡方程。
这里应该指出,对于具有不变内能和容积、或者具有不变温度和容积的封闭系统,从建立稳定平衡的条件出发,都可以得到与式(4-33)完全相同的表达式。所以,式(4-33)乃是化学平衡方程的一般形式。
因为组分的化学位在数值上等于1mol该组分的吉布斯自由能,即
\({{G}_{j}}={{\mu }_{j}}\) (4-34)
因此
\(\tilde{G}=\sum\limits_{j=1}^{k}{{{\mu }_{j}}{{n}_{j}}}\)
式中\(\tilde{G}\)的单位为kJ/kg,μj的单位为kJ/mol,nj的单位为mol/kg。式(4-34)也可写为
\({{\mu }_{j}}={{G}_{j}}={{H}_{j}}-T{{S}_{j}}\) (4-35)
式中 Gj——1molj组分的吉布斯自由能;
Hj、Sj——1molj组分的焓和熵。因为
\({{\mu }_{j}}=\mu _{j}^{0}+{{R}_{0}}T\ln {{p}_{j}}\) (4-36)
式中 \(\mu _{j}^{0}\)——一个物理大气压条件下1molj组分的化学位,称为标准化学位,它是温度的函数;(正因为\(\mu _{j}^{0}\)是在一个物理大气压条件下的数值,所以pj的单位也应取为物理大气压,这是在热力计算时必须注意到的。)
pj——组分的分压;
R0——通用气体常数,其值为
国际单位制 R0=8.3144kJ/(kmol·K)
工程单位制 R0=848kgf·m/(kmol·K)
R0=1.987kcal/(kmol·K)
气相组分的化学位可以直接利用式(4-36)计算。凝相组分的化学位则利用下面的关系确定:当凝相与气相处于相平衡时,两个相的化学位相等,即
\(\mu _{j}^{c}={{\mu }_{j}}\)
而这时该组分气相状态的化学位为
\({{\mu }_{j}}=\mu _{j}^{0}+{{R}_{0}}T\ln {{p}_{j,V}}\)
式中 pj.v——该温度下该组分的饱和蒸气压,它是温度的函数。因此
\(\mu _{j}^{c}=\mu _{j}^{0}+{{R}_{0}}T\ln {{p}_{j,V}}\) (4-37)
由式(4-37)可见,\(\mu _{j}^{c}\)只是温度的函数,而与压强无关。因此,\(\mu _{j}^{c}\)的数值可以按照温度直接从有关的热力学性质表中查得。
化学平衡方程除了式(4-33)的形式以外,还有其它形式的表达式。现在分析一个任意的可逆化学反应
\(aA+bB\leftrightarrow cC+dD\)
式中 A、B——表示参加反应的反应物;
C、D——表示化学反应的生成物;
a、b、c、d——分别代表反应物和生成物在反应过程中的化学计量系数。
当化学反应处于平衡状态时,根据式(4-33)可以写出
\(\sum{{{\mu }_{j}}\text{d}{{n}_{j}}={{\mu }_{A}}\text{d}{{n}_{A}}+}{{\mu }_{B}}\text{d}{{n}_{B}}+{{\mu }_{C}}\text{d}{{n}_{C}}+{{\mu }_{D}}\text{d}{{n}_{D}}=0\) (4-38)
因为
\(\frac{\text{d}{{n}_{C}}}{c}=\frac{\text{d}{{n}_{D}}}{d}=\frac{-\text{d}{{n}_{A}}}{a}=\frac{-\text{d}{{n}_{B}}}{b}\)
将上式代入式(4-38),即得
\(c{{\mu }_{C}}+d{{\mu }_{D}}-a{{\mu }_{A}}-b{{\mu }_{B}}=0\) (4-39)
将式(4-36)代入式(4-39),经过整理后得
\(\ln {{K}_{p}}=\frac{1}{{{R}_{0}}T}(a\mu _{A}^{0}+b\mu _{B}^{0}-c\mu _{C}^{0}-d\mu _{D}^{0})\) (4-40)
式中 Kp——以气体分压表示的平衡常数,即
\({{K}_{p}}=\frac{p_{C}^{c}p_{D}^{d}}{p_{A}^{a}p_{B}^{b}}\) (4-41)
因为\(\mu _{A}^{0}、\mu _{B}^{0}、\mu _{c}^{0}、\mu _{D}^{0}\)仅是温度的函数,因此由式(4-40)可见,Kp也只是温度的函数,而与压强无关,它的值也可由有关的热力学性质表中查得,或见附录4-1。
对于含有凝相组分的化学反应,其化学平衡常数用下面的方法确定。以下述反应为例
\(\text{A}{{\text{l}}_{\text{2}}}{{\text{O}}_{\text{3}}}(c)\leftrightarrow \text{2Al}+\frac{\text{3}}{\text{2}}{{\text{O}}_{\text{2}}}\)
该反应的化学平衡常数可写为
\({{K}_{p}}=\frac{p_{\text{Al}}^{\text{2}}p_{{{\text{O}}_{2}}}^{3/2}}{{{p}_{\text{A}{{\text{l}}_{\text{2}}}{{\text{O}}_{\text{3}}}(c)}}}\)
式中 \({{p}_{\text{A}{{\text{l}}_{\text{2}}}{{\text{O}}_{\text{3}}}(c)}}\)——凝相Al2O3(c)的饱和蒸气压。它只是温度的函数,所以可将\({{p}_{\text{A}{{\text{l}}_{\text{2}}}{{\text{O}}_{\text{3}}}(c)}}\)与Kp合并,于是得到含有凝相组分的可逆反应的平衡常数,即
\(K_{p}^{c}={{p}_{\text{A}{{\text{l}}_{\text{2}}}{{\text{O}}_{\text{3}}}(c)}}{{K}_{p}}=p_{\text{Al}}^{2}p_{{{\text{O}}_{\text{2}}}}^{3/2}\)
由上式可以看出,对于含有凝相组分的可逆反应,其平衡常数\(K_{p}^{c}\)可以只用气相组分的分压表示。\(K_{p}^{c}\)值由有关的热力学性质表中查得。
还可以有其它形式的化学平衡常数,例如用组分的摩尔数表示的化学平衡常数Kn。根据道尔顿分压定律,有
\(\frac{{{p}_{j}}}{p}=\frac{{{n}_{j}}}{n}\)
或者
\({{p}_{j}}=\frac{p{{n}_{j}}}{n}\) (4-42)
式中 n—— 一千克混合气体的摩尔总数;
p—— 混合气体的压强。
将式(4-42)代入式(4-41),得
\(\frac{n_{C}^{c}n_{D}^{d}}{n_{A}^{a}n_{B}^{b}}{{\left( \frac{p}{n} \right)}^{c+d-a-b}}={{K}_{p}}\)
令
\(\frac{n_{C}^{c}n_{D}^{d}}{n_{A}^{a}n_{B}^{b}}={{K}_{n}}\) (4-43)
则
\({{K}_{n}}={{K}_{p}}{{\left( \frac{p}{n} \right)}^{a+b-c-d}}\) (4-44)
式中Kn为用摩尔数表示的化学平衡常数,它不仅是温度的函数,而且也是压强的函数。
现在令
\(\Delta v=(c+d)-(a+b)\)
式中\(\Delta v\)为化学反应前后系统中摩尔数的增量。若将关系式(4-43)代入式(4-44),则得
\(\frac{n_{C}^{c}n_{D}^{d}}{n_{A}^{a}n_{B}^{b}}={{K}_{p}}{{\left( \frac{p}{n} \right)}^{-\Delta v}}\) (4-45)
式(4-45)就是用化学平衡常数形式写出的化学平衡方程。该式清楚地表示出化学反应达到平衡时,参加可逆反应的各物质的摩尔数与温度和压强之间的关系。在给定温度和压强条件下,该式反映了参加反应的各物质摩尔数之间的关系。
化学平衡方程还可以写成其它的形式。如果所研究的可逆化学反应用下述一般形式表示:
\({{v}_{1}}{{A}_{1}}+{{v}_{2}}{{A}_{2}}\leftrightarrow {{v}_{3}}{{A}_{3}}+{{v}_{4}}{{A}_{4}}\)
则当系统处于化学平衡状态时,根据式(4-33)可写出类似于式(4-39)的化学平衡方程:
\({{v}_{3}}{{\mu }_{3}}+{{v}_{4}}{{\mu }_{4}}-{{v}_{1}}{{\mu }_{1}}-{{v}_{2}}{{\mu }_{2}}=0\)
或
\(\sum\limits_{j=1}^{K}{{{v}_{j}}{{\mu }_{j}}=0}\) (4-46)
式中 K——该化学反应中所有组分的总数;
νj——反应过程中j组分的化学计量系数,对于反应物νj取负号,对于生成物νj取正号。
式(4-46)也是化学平衡方程广泛采用的形式。
如前所述,化学平衡是有条件的,是相对的。大量试验表明,当决定平衡状态的外界条件变化时,旧的平衡状态就被破坏,平衡向削弱外界条件变化的影响的方向移动,直至在新的条件下建立新的平衡状态为止。这就叫做平衡移动原理,即吕·查德里(Le Chatlier)原理。在新的平衡状态下,正向反应速度与逆向反应速度虽然也是相等的,但与旧的平衡状态时的速度不同了。与此同时,新平衡状态下各个组分的浓度也与旧平衡状态下的浓度不同。
影响化学平衡的主要条件是温度和压强。下面讨论当温度和压强变化时,化学平衡如何移动。
1.温度对化学平衡的影响
系统的温度对化学平衡的影响,与化学反应是吸热的还是放热的有关。对于吸热反应,当外界对系统加热时,系统的温度升高,Kp值增大,使吸热反应的生成物的浓度增大。例如,对于可逆反应
\(\text{C}{{\text{O}}_{\text{2}}}\leftrightarrow \text{CO}+\frac{\text{1}}{\text{2}}{{\text{O}}_{\text{2}}}-283.043\)kJ/mol
中的正向吸热反应,当温度升高时,使CO和O2的浓度增大,CO2的浓度减少。平衡移动的结果使反应放出的热量减少,从而使系统温度降低,这就削弱了原来系统温度升高的影响。反之,系统温度降低时,平衡向放热反应方向移动,Kp值减小,即CO2的浓度增加,CO和O2的浓度减小。平衡移动的结果使反应放出的热量增多,因而使温度升高,以削弱原来系统温度降低的影响。
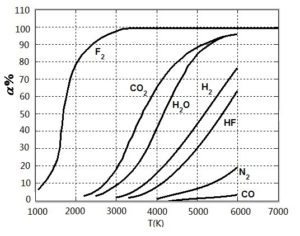
因为离解反应是吸热反应,所以提高温度使平衡向离解反应的方向移动,从而使离解产物的浓度增大。但是对于不同的燃烧产物,温度对其离解程度的影响是不同的。图4-2表示了某些燃烧产物的离解度\(\alpha \)(即被离解的摩尔数与起始摩尔数之比)受温度影响的情况。由图线可以看出,对于每一种燃烧产物来说,当温度升高时离解度都增大。但在同一温度下,不同燃烧产物的离解度之间的差别是很大的,例如CO2较易离解,而CO则很难离解。
图4-2 不同气体的离解度与温度的关系(pc=101.32×105Pa)
2.压强对化学平衡的影响
系统的压强对化学平衡的影响与反应过程中气体摩尔数的变化有关。在一定的容积内,气体的分压与它的摩尔数成正比。当系统的压强升高时,平衡向着减少气体摩尔数的方向移动,即向着减少系统压强的方向移动,以削弱压强升高的影响;反之,当压强降低时,平衡向着增加气体摩尔数的方向移动,即向着增大系统压强的方向移动,以削弱系统压强降低的影响。
对于上述CO2离解为CO和O2的可逆反应,当系统内压强升高时,平衡向着CO和O2复合成CO2的方向移动,以减少系统中气体的摩尔数。当系统内压强降低时,平衡向着CO2离解为CO和O2的方向移动,使系统内气体的摩尔数增大,以削弱压强降低的影响。由此可见,提高燃烧室压强,可使离解产物的浓度减少,有利于减少离解损失。
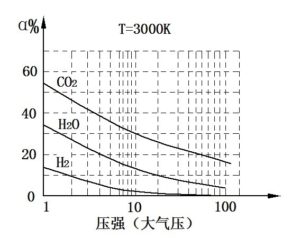
对于不同的燃烧产物,压强对其离解度的影响也是不同的,如图4-3所示。
图4-3 不同气体的离解度与压强的关系(T=3000K)
比较图4-2与图4-3可以看出,提高系统的温度或压强对离解的影响相反,但是温度对离解的影响要比压强对离解的影响大得多。
由以上分析可知,化学平衡是与一定的温度和压强条件相适应的。当温度、压强发生了变化,则旧的化学平衡状态被破坏,经过一定的时间(通常称为松弛时间),重新建立起新的平衡状态。松弛时间与化学反应的速度有关,若化学反应很快,则松弛时间就较短,这时就有可能使化学反应在系统温度和压强变化的过程中始终处于化学平衡状态;反之,化学反应就可能不能处于化学平衡状态。
三、能量守恒方程
对于燃烧室热力计算来说,在§4.1节中已经假定燃烧室内处于绝热状态,即燃烧室与外界没有热量交换。因此,从能量守恒角度来说,固体推进剂燃烧产物的总焓应该等于固体推进剂的总焓。即
\({{\tilde{I}}_{m}}={{\tilde{I}}_{p}}\) (4-1)
固体推进剂燃烧产物的总焓\({{\tilde{I}}_{m}}\)等于燃烧产物中各平衡组分的总焓之和了,若已知1kg质量的燃烧产物中各平衡组分的摩尔数\({{n}_{j}}(j=1,2,\cdots ,N)\)(注意:此处是绝对的摩尔数量,并非相对的摩尔分数,且hj是温度T和压强p的函数),则1kg燃烧产物的总焓为
\({{\tilde{I}}_{m}}=\sum\limits_{j=1}^{N}{{{I}_{j}}{{n}_{j}}}\) (4-47)
式中 Ij——1mol第j组分在给定温度下的总焓,单位为kJ/mol,Ij是温度T的函数。在附录4-3中列有一部分组分的Ij随温度变化的数据,在查用不同资料的数据表时,应注意物理量的单位。在利用计算机编程计算时,表格形式的数据使用不便,通常用解析形式的公式。在§4.8节中将对热力学数据库使用方法进行介绍,会给出各种热力学参数的解析计算公式。
四、燃烧室热力计算的一般步骤
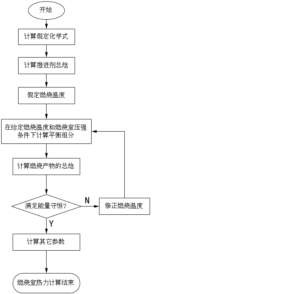
在§4.1节中已经介绍了燃烧室热力计算的内容大体上可分为三个部分:一是计算固体推进剂的假定化学式与总焓;二是根据质量守恒方程和化学平衡方程,在给定压强和温度条件下计算平衡组分;三是根据能量守恒方程确定燃烧温度,然后求出该温度下燃烧产物的平衡组分、物性参数和特征速度等。燃烧室热力计算的一般步骤如图4-4所示。
首先按照§4.1节介绍的方法计算推进剂的假定化学式和总焓,然后对推进剂的燃烧温度进行预估,预估值\({{T}_{f}}^{*}\)可以参考同类推进剂的燃烧温度。如果预估值与实际燃烧温度Tf很接近,那么只需要进行2~3次迭代计算就可以完成燃烧室热力计算,如果预估值偏离实际值较大,就需要更多次迭代计算。基于燃烧温度预估值\({{T}_{f}}^{*}\)和已知的燃烧室压强pc,求解化学平衡状态下推进剂燃烧产物的摩尔数nj。求解方法可以使用本章§4.3节至§4.5节介绍的化学平衡常数法、最小吉布斯自由能法或布林克莱法。得到燃烧产物摩尔数nj之后,按照式(4-47)计算燃烧产物的总焓\(\tilde{I}_{m}^{*}\)。根据能量守恒可知,计算结果应该满足条件
\(\tilde{I}_{m}^{*}={{\tilde{I}}_{p}}\)
但实际计算过程中很难实现数值上绝对精确的相等,因此可以给定允许的相对误差εI,只要满足下面的条件即认为达到了能量守恒。
\(\frac{\left| \tilde{I}_{m}^{*}-{{{\tilde{I}}}_{p}} \right|}{{{{\tilde{I}}}_{p}}}\le {{\varepsilon }_{I}}\) (4-48)
如果不满足能量守恒条件,就需要对燃烧温度预估值进行修正,重新开展给定燃烧温度和燃烧室压强条件下的平衡组分计算,重复上面的过程,直到满足能量守恒条件。关于燃烧温度预估值修正方法将在§4.6节中进行介绍。
图4-4 燃烧室热力计算的一般流程
§4.3 计算平衡组分的化学平衡常数法
化学平衡常数法采用以化学平衡常数表示的化学平衡方程(4-45)来计算平衡组分。
现在结合具体的例子说明这种计算方法。
[例4-3] 例4-2中某聚硫复合固体推进剂的假定化学式为
\({{\text{C}}_{10.120}}{{\text{H}}_{40.976}}{{\text{O}}_{27.127}}{{\text{N}}_{\text{6}\text{.085}}}\text{C}{{\text{l}}_{\text{6}\text{.085}}}{{\text{S}}_{\text{2}\text{.417}}}\text{A}{{\text{l}}_{\text{0}\text{.9259}}}\)
计算在T=3000K,\(p=1.01325\times {{10}^{7}}\)Pa条件下该推进剂燃烧产物的平衡组分。
解:计算步骤如下:
1.根据固体推进剂中含有元素的情况,确定燃烧产物中含有组分的种类
在上节中说明了含C、H、O、N推进剂的燃烧产物中的主要组分。在本推进剂中含有这四种元素,因此确定在该推进剂的燃烧产物中含有组分:CO2、H2O、CO、H2、N2、OH、O2、NO、H。
在本推进剂中除了含C、H、O、N元素以外,还含有Cl、S、Al元素。
对于含有Cl元素的推进剂,在燃烧产物中可能有HCl、Cl、Cl2、…等组分,但其主要组分是HCl和Cl。所以,确定在本推进剂的燃烧产物中含有组分:HCl、Cl。
对于含有S元素的推进剂,在燃烧产物中可能有SO2、SO、SO3、…等组分,但其主要组分是SO2。所以,确定在本推进剂的燃烧产物中含有组分SO2。
对于含有Al元素的推进剂,在燃烧产物中可能有Al2O3(c)、Al2O3(g)、Al2O、AlO、AlCl3、…等组分。在燃烧温度不太高的条件下,Al2O3(c)的含量最多。因此确定在本推进剂的燃烧产物中含有组分:Al2O3(c)。
综上所述,在本推进剂的燃烧产物中确定共含有13种组分:Al2O3(c)、CO2、H2O、CO、H2、N2、HCl、SO2、O2、OH、NO、H、Cl。
如果实际存在于该推进剂燃烧产物中的主要组分,无遗漏地都包含在所选取的13种组分之内,则可得到准确的计算结果。不然,就会给计算结果带来误差。所以,为了提高计算精度,常常多选取一些组分包含在燃烧产物之中。
2.单位换算
将压强的单位换算为物理大气压
\(p=1.01325\times {{10}^{7}}\)Pa=100物理大气压
3.根据燃烧产物中含有组分的情况,确定建立化学平衡方程的化学反应过程
在本例中,这些化学反应过程是:
(1)CO2离解为CO和O2的反应
\(\text{C}{{\text{O}}_{\text{2}}}\leftrightarrow \text{CO}+\frac{\text{1}}{\text{2}}{{\text{O}}_{\text{2}}}\) (4-49)
(2)气态H2O离解为H2和O2的反应
\({{\text{H}}_{\text{2}}}\text{O}\leftrightarrow {{\text{H}}_{\text{2}}}+\frac{\text{1}}{\text{2}}{{\text{O}}_{\text{2}}}\) (4-50)
(3)水煤气反应
\(\text{C}{{\text{O}}_{\text{2}}}+{{\text{H}}_{\text{2}}}\leftrightarrow \text{CO}+{{\text{H}}_{\text{2}}}\text{O}\) (4-51)
应该注意到上述三种反应中只有两个是独立的,因为其中一个反应可由另外两种反应导出。例如式(4-50)与式(4-51)的反应,两式相加即可导出式(4-49)的反应。在燃烧温度较低时,前两种反应的化学平衡常数\({{K}_{p,C{{O}_{2}}}}\)和\({{K}_{p,{{H}_{2}}O}}\)的数值较小。为了计算方便常采用水煤气反应的化学平衡方程,然后在前两种反应中再选择一个建立化学平衡方程,在本例中选择了反应(2)。
(4)气态H2O离解为OH和H2的反应
\({{\text{H}}_{\text{2}}}\text{O}\leftrightarrow \text{OH}+\frac{\text{1}}{\text{2}}{{\text{H}}_{\text{2}}}\) (4-52)
(5)H2离解为H的反应
\({{\text{H}}_{\text{2}}}\leftrightarrow \text{2H}\) (4-53)
(6)HCl离解为H和Cl的反应
\(\text{HCl}\leftrightarrow \text{H}+\text{Cl}\) (4-54)
(7)N2和O2生成NO的反应
\({{\text{N}}_{\text{2}}}+{{\text{O}}_{\text{2}}}\leftrightarrow \text{2NO}\) (4-55)
上述化学反应中的各个组分,必须都是包含在燃烧产物中的组分。
4.建立在给定温度和压强条件下计算平衡组分的控制方程组
根据式(4-19)可建立7个质量守恒方程:
\({{n}_{C{{O}_{2}}}}+{{n}_{CO}}={{N}_{C}}=10.120\) (4-56)
\(2{{n}_{{{H}_{2}}O}}+2{{n}_{{{H}_{2}}}}+{{n}_{HCl}}+{{n}_{OH}}+{{n}_{H}}={{N}_{H}}=40.976\) (4-57)
\(2{{n}_{C{{O}_{2}}}}+{{n}_{{{H}_{2}}O}}+2{{n}_{S{{O}_{2}}}}+{{n}_{CO}}+2{{n}_{{{O}_{2}}}}+{{n}_{OH}}+{{n}_{NO}}+3{{n}_{Al2O2(c)}}={{N}_{O}}=27.127\) (4-58)
\(2{{n}_{{{N}_{2}}}}+{{n}_{NO}}={{N}_{N}}=6.085\) (4-59)
\({{n}_{HCl}}+{{n}_{Cl}}={{N}_{Cl}}=6.085\) (4-60)
\({{n}_{S{{O}_{2}}}}={{N}_{S}}=2.417\) (4-61)
\(2{{n}_{A{{l}_{2}}{{O}_{3}}(c)}}={{N}_{Al}}=0.9259\) (4-62)
按照方程(4-45),对化学反应式(4-50)~(4-55)建立化学平衡方程。式中有关反应的化学平衡常数取自附录4-1。当时,它们的值列于表4-3中。
表4-3 时的化学平衡常数
| 3000K | |
| 水煤气反应的Kp
反应(4-50)的\({{K}_{p,{{H}_{2}}O}}\) 反应(4-52)的\({{{K}’}_{p,{{H}_{2}}O}}\) 反应(4-53)的\({{K}_{p,{{H}_{2}}}}\) 反应(4-54)的\({{K}_{p,HCl}}\) 反应(4-55)的\({{K}_{p,NO}}\) |
7.3820
0.4628×10-1 0.4841×10-1 0.2475×10-1 1.7070×10-2 0.1472×10-1 |
在查用化学学平衡常数的数据表时,应注意表中Kp所对应的化学反应式必须与式(4-45)左方式子所对应的反应式相同。
对应于式(4-50)~(4-55)的化学平衡方程如下:
\(\frac{{{n}_{{{H}_{2}}}}n_{{{O}_{2}}}^{1/2}}{{{n}_{{{H}_{2}}O}}}={{K}_{p\cdot {{H}_{2}}O}}{{\left( \frac{p}{{{n}_{g}}} \right)}^{-\frac{1}{2}}}\) (4-63)
\(\frac{{{n}_{CO}}{{n}_{{{H}_{2}}O}}}{{{n}_{C{{O}_{2}}}}{{n}_{{{H}_{2}}}}}={{K}_{p}}\) (4-64)
\(\frac{{{n}_{OH}}n_{{{H}_{2}}}^{1/2}}{{{n}_{{{H}_{2}}O}}}={K}_{p\cdot {{H}_{2}}O}^{{‘}}{{\left( \frac{p}{{{n}_{g}}} \right)}^{-\frac{1}{2}}}\) (4-65)
\(\frac{n_{H}^{2}}{{{n}_{{{H}_{2}}}}}={{K}_{p\cdot {{H}_{2}}}}{{\left( \frac{p}{{{n}_{g}}} \right)}^{-1}}\) (4-66)
\(\frac{{{n}_{H}}{{n}_{Cl}}}{{{n}_{HCl}}}={{K}_{p\cdot HCl}}{{\left( \frac{p}{{{n}_{g}}} \right)}^{-1}}\) (4-67)
\(\frac{n_{NO}^{2}}{{{n}_{{{N}_{2}}}}{{n}_{{{O}_{2}}}}}={{K}_{p\cdot NO}}\) (4-68)
在方程(4-63)、(4-65)~(4-67)中引入了一个新未知量ng,它代表系统中气相组分的总摩尔数,因此还需补充一个关系式
\({{n}_{g}}={{n}_{C{{O}_{2}}}}+{{n}_{{{H}_{2}}O}}+{{n}_{CO}}+{{n}_{{{H}_{2}}}}+{{n}_{{{N}_{2}}}}+{{n}_{HCl}}+{{n}_{S{{O}_{2}}}}+{{n}_{{{O}_{2}}}}+{{n}_{OH}}+{{n}_{NO}}+{{n}_{H}}+{{n}_{Cl}}\) (4-69)
现在共有14个未知数:\({{n}_{A{{l}_{2}}{{O}_{3}}(c)}}、{{n}_{CO}}、{{n}_{{{H}_{2}}O}}、{{n}_{CO}}、{{n}_{{{H}_{2}}}}、{{n}_{{{N}_{2}}}}\)、\({{n}_{HCl}}、{{n}_{S{{O}_{2}}}}、{{n}_{{{O}_{2}}}}、{{n}_{OH}}、{{n}_{NO}}、{{n}_{H}}、{{n}_{Cl}}、{{n}_{g}}\),共有独立的方程(4-56)~(4-69),也是14个,因此这个方程组是封闭的、可解的。
5.求解控制方程组的方法
方程(4-56)~(4-62)及式(4-69)都是线性的代数方程,而方程(4-63)~(4-68)则是非线性的代数方程。求解非线性的方程组一般利用迭代的方法。在文献[1]中介绍了一种求解该方程组的方法,该方法将全部组分区分为主要组分和次要组分,并在第一次近代计算中令次要组分的nj等于零,在此基础上求出主要组分的近似值,然后逐步近似、迭代求解,因此称为逐步近似法。
观察方程组(4-56)~(4-62),其中方程(4-61)、(4-62)非常简单,由它们可以直接求出\({{n}_{S{{O}_{2}}}}、{{n}_{A{{l}_{2}}{{O}_{3}}(c)}}\):
\({{n}_{S{{O}_{2}}}}=2.417\)
\({{n}_{A{{l}_{2}}{{O}_{3}}(c)}}=0.4629 \)
在进一步计算时,为了计算方便,改写方程组(4-56)~(4-60)和(4-63)~(4-69),并重新排列,则得
\({{n}_{C{{O}_{2}}}}+{{n}_{CO}}={{N}_{C}}\) (4-56)'
\(2{{n}_{{{H}_{2}}O}}+2{{n}_{{{H}_{2}}}}={{N}_{H}}-{{n}_{HCl}}-{{n}_{OH}}-{{n}_{H}}={N}_{H}^{{‘}}\) (4-57)'
\(2{{n}_{C{{O}_{2}}}}+{{n}_{{{H}_{2}}O}}+{{n}_{CO}}={{N}_{O}}-2{{n}_{S{{O}_{2}}}}-3{{n}_{A{{l}_{2}}{{O}_{3}}(c)}}-2{{n}_{{{O}_{2}}}}-{{n}_{OH}}-{{n}_{NO}}={N}_{O}^{{‘}}\) (4-58)'
\(\frac{{{n}_{CO}}{{n}_{{{H}_{2}}O}}}{{{n}_{C{{O}_{2}}}}{{n}_{{{H}_{2}}}}}={{K}_{p}}\) (4-64)'
以及
\(2{{n}_{{{N}_{2}}}}={{N}_{N}}-{{n}_{NO}}\) (4-59)'
\({{n}_{HCl}}={{N}_{Cl}}-{{n}_{Cl}}\) (4-60)'
以及
\({{n}_{{{O}_{2}}}}={{\left( \frac{{{n}_{{{H}_{2}}O}}}{{{n}_{{{H}_{2}}}}} \right)}^{2}}K_{p\cdot {{H}_{2}}O}^{2}{{\left( \frac{p}{{{n}_{g}}} \right)}^{-1}}\) (4-63)'
\({{n}_{OH}}=\frac{{{n}_{{{H}_{2}}O}}}{n_{{{H}_{2}}}^{1/2}}{K}_{p\cdot {{H}_{2}}O}^{{‘}}{{\left( \frac{p}{{{n}_{g}}} \right)}^{-\frac{1}{2}}}\) (4-65)'
\({{n}_{H}}={{({{n}_{{{H}_{2}}}}{{K}_{p\cdot {{H}_{2}}}})}^{\frac{1}{2}}}{{\left( \frac{p}{{{n}_{g}}} \right)}^{-\frac{1}{2}}}\) (4-66)'
\({{n}_{Cl}}=\frac{{{n}_{HCl}}}{{{n}_{H}}}{{K}_{p\cdot HCl}}{{\left( \frac{p}{{{n}_{g}}} \right)}^{-1}}\) (4-67)'
\({{n}_{NO}}={{({{n}_{{{N}_{2}}}}{{n}_{{{O}_{2}}}}{{K}_{p\cdot NO}})}^{1/2}}\) (4-68)'
\({{n}_{g}}={{n}_{C{{O}_{2}}}}+{{n}_{{{H}_{2}}O}}+{{n}_{CO}}+{{n}_{{{H}_{2}}}}+{{n}_{{{N}_{2}}}}+{{n}_{HCl}}+{{n}_{S{{O}_{2}}}}+{{n}_{{{O}_{2}}}}+{{n}_{OH}}+{{n}_{NO}}+{{n}_{H}}+{{n}_{Cl}}\)(4-69)'
在第一次近似计算中,令浓度比较小的组分O2、OH、H、Cl、NO的摩尔数:\({{n}_{{{O}_{2}}}}、{{n}_{OH}}、{{n}_{H}}、{{n}_{Cl}}、{{n}_{NO}}\)等于零。则由式(4-59)'、(4-60)'可直接求出\({{n}_{{{N}_{2}}}}\)、\({{n}_{HCl}}\)的近似值。这时方程组就简化为只包含式(4-56)'~(4-58)'及式(4-64)'四个方程,去求解\({{n}_{C{{O}_{2}}}}、{{n}_{CO}}、{{n}_{{{H}_{2}}O}}、{{n}_{{{H}_{2}}}}\)四个未知数。这样,在第一次近似计算中,可以求出\(n_{C{{O}_{2}}}^{(1)}、n_{CO}^{(1)}、n_{{{H}_{2}}O}^{(1)}、n_{{{H}_{2}}}^{(1)}、n_{{{N}_{2}}}^{(1)}、n_{HCl}^{(1)}\)的近似值,以及\({{n}_{S{{O}_{2}}}}、{{n}_{A{{l}_{2}}{{O}_{3}}(c)}}\)的值,其余组分的摩尔数都取为零,然后根据式(4-69)'计算\(n_{g}^{(2)}\)。符号上角标“1”表示为第一次近似计算结果。
在第二次计算中,首先根据第一次近似计算的结果,按照式(4-63)'、(4-65)'~(4-68)'计算次要组分的摩尔数:\(n_{{{O}_{2}}}^{(2)}、n_{OH}^{(2)}、n_{H}^{(2)}、n_{Cl}^{(2)}、n_{NO}^{(2)}\)。然后按照式(4-59)'、(4-60)'计算\(n_{{{N}_{2}}}^{(2)}、n_{HCl}^{(2)}\);按照式(4-56)'~(4-58)'以及(4-64)'计算\(n_{C{{O}_{2}}}^{(2)}、n_{CO}^{(2)}、n_{{{H}_{2}}O}^{(2)}、n_{{{H}_{2}}}^{(2)}\);按照式(4-69)'计算\(n_{g}^{(2)}\)。这样就得到了第二次近似计算的结果,并构成了一种迭代计算的格式。此后,按此格式进行迭代计算,直到两次相邻的计算结果达到所要求的精度为止。
这里,还需要说明一个问题:如何根据式(4-56)'~(4-58)'及式(4-5164)'求解\({{n}_{C{{O}_{2}}}}、{{n}_{CO}}、{{n}_{{{H}_{2}}O}}、{{n}_{{{H}_{2}}}}\)。
利用关系式(4-56)'~(4-58)',可将\({{n}_{CO}}、{{n}_{{{H}_{2}}O}}、{{n}_{{{H}_{2}}}}\)写成\({{n}_{C{{O}_{2}}}}\)的函数,即
\( {{n}_{CO}}={{N}_{C}}-{{n}_{C{{O}_{2}}}}\)
\({{n}_{{{H}_{2}}O}}=A-{{n}_{C{{O}_{2}}}}\)
\({{n}_{{{H}_{2}}}}=B+{{n}_{C{{O}_{2}}}}\)
(4-70)
式中
\( A={N}_{O}^{{‘}}-{{N}_{C}}\)
\(B=\frac{{N}_{H}^{{‘}}}{2}-A\)
将式(4-70)代入式(4-64),整理后得
\(({{K}_{p}}-1)n_{C{{O}_{2}}}^{2}+({{K}_{p}}B+{N}_{O}^{{‘}}){{n}_{C{{O}_{2}}}}-A{{N}_{C}}=0\)
上述一元二次方程有两个根,舍去负根(因为不合理)取正根,得
\({{n}_{C{{O}_{2}}}}=\frac{1}{2({{K}_{p}}-1)}[-({{K}_{p}}B+{N}_{O}^{{‘}})+\sqrt{{{({{K}_{p}}B+{N}_{O}^{{‘}})}^{2}}+4({{K}_{p}}-1)A{{N}_{C}}}]\) (4-71)
由式(4-71)求出\({{n}_{C{{O}_{2}}}}\)后,代入式(4-70)即可求出\({{n}_{CO}}、{{n}_{{{H}_{2}}O}}、{{n}_{{{H}_{2}}}}\)各值。
6.根据控制方程组的求解方法,设计出计算链
在表4-4中介绍了一种可供使用的计算次序,并附有两次计算的数据,可供参考。
表4-4 计算平衡组分的计算链
| 序号 | 计 算 式 | 第一次 | 第二次 | |
| 1 | \(n_{{{O}_{2}}}^{(i)}=K_{p\cdot {{H}_{2}}O}^{2}{{(n_{{{H}_{2}}O}^{(i-1)}/n_{{{H}_{2}}}^{(i-1)})}^{2}}{{(p/n_{g}^{(i-1)})}^{-1}}\) | 0 | 1.144E-3 | |
| 2 | \(n_{OH}^{(i)}={K}_{p\cdot {{H}_{2}}O}^{{‘}}n_{{{H}_{2}}O}^{(i-1)}{{(p/n_{g}^{(i-1)})}^{-1/2}}/{{(n_{{{H}_{2}}}^{(i-1)})}^{1/2}}\) | 0 | 1.0035E-1 | |
| 3 | \(n_{H}^{(i)}=K_{p\cdot {{H}_{2}}}^{1/2}{{(n_{{{H}_{2}}}^{(i-1)})}^{1/2}}{{(p/n_{g}^{(i-1)})}^{-1/2}}\) | 0 | 2.7905E-1 | |
| 4 | \(n_{Cl}^{(i)}={{K}_{p\cdot HCl}}(n_{HCl}^{(i-1)}/n_{H}^{(i)}){{(p/n_{g}^{(i-1)})}^{-1}}\) | 0 | 1.4558E-1 | |
| 5 | \(n_{NO}^{(i)}=K_{p\cdot NO}^{1/2}{{(n_{{{N}_{2}}}^{(i-1)}n_{{{O}_{2}}}^{(i)})}^{1/2}}\) | 0 | 7.1579E-3 | |
| 6 | \(n_{{{N}_{2}}}^{(i)}=\frac{1}{2}({{N}_{N}}-n_{NO}^{(i)})\) | 3.0425 | 3.0389 | |
| 7 | \(n_{HCl}^{(i)}={{N}_{Cl}}-n_{Cl}^{(i)}\) | 6.0850 | 5.9394 | |
| 8 | \({{n}_{S{{O}_{2}}}}={{N}_{S}}\) | 2.4170 | 2.4170 | |
| 9 | \({{n}_{A{{l}_{2}}{{O}_{3}}(c)}}=\frac{1}{2}{{N}_{Al}}\) | 0.4629 | 0.4629 | |
| 10 | \({N}'{{_{H}^{{}}}^{(i)}}={{N}_{H}}-n_{HCl}^{(i)}-n_{OH}^{(i)}-n_{H}^{(i)}\) | 34.8910 | 34.6572 | |
| 11 | \({N}'{{_{O}^{{}}}^{(i)}}={{N}_{O}}-3{{n}_{A{{l}_{2}}{{O}_{3}}(c)}}-2{{n}_{S{{O}_{2}}}}-2n_{{{O}_{2}}}^{(i)}-n_{OH}^{(i)}-n_{NO}^{(i)}\) | 20.9041 | 20.7944 | |
| 12 | \({{A}^{(i)}}={N}'{{_{O}^{{}}}^{(i)}}-{{N}_{C}}\) | 10.7841 | 10.6744 | |
| 13 | \({{B}^{(i)}}=\frac{1}{2}{N}'{{_{H}^{{}}}^{(i)}}-{{A}^{(i)}}\) | 6.6614 | 6.6542 | |
| 14 | \( n_{C{{O}_{2}}}^{(i)}=\frac{1}{2({{K}_{p}}-1)}\{[{{({{K}_{p}}{{B}^{(i)}}+{N}'{{_{O}^{{}}}^{(i)}})}^{2}} \)
\(\text{ } +4\text{(}{{K}_{p}}-1\text{)}{{A}^{(i)}}{{N}_{C}}{{]}^{1/2}}-({{K}_{p}}{{B}^{(i)}}+{N}'{{_{O}^{{}}}^{(i)}})\}\) |
1.3831 | 1.3730 | |
| 15 | \(n_{CO}^{(i)}={{N}_{C}}-n_{C{{O}_{2}}}^{(i)}\) | 8.7369 | 8.7470 | |
| 16 | \(n_{{{H}_{2}}O}^{(i)}={{A}^{(i)}}-n_{C{{O}_{2}}}^{(i)}\) | 9.4010 | 9.3014 | |
| 17 | \(n_{{{H}_{2}}}^{(i)}={{B}^{(i)}}+n_{C{{O}_{2}}}^{(i)}\) | 8.0445 | 8.0272 | |
| 18 | \(n_{g}^{(i)}=n_{C{{O}_{2}}}^{(i)}+n_{{{H}_{2}}O}^{(i)}+n_{CO}^{(i)}+n_{{{H}_{2}}}^{(i)}+n_{{{N}_{2}}}^{(i)}+n_{HCl}^{(i)}+n_{S{{O}_{2}}}^{(i)} \)
\(\text{ }+n_{{{O}_{2}}}^{(i)}+n_{OH}^{(i)}+n_{NO}^{(i)}+n_{H}^{(i)}+n_{Cl}^{(i)}\) |
39.1100 | 39.3772 | |
经过五次计算,已知达到所要求的精度(0.01%),整个计算到此结束。最后,求得的平衡组分为
\({{n}_{A{{l}_{2}}{{O}_{3}}(c)}}=0.4629\)mol/kg; \({{n}_{C{{O}_{2}}}}=1.3733\)mol/kg。
\({{n}_{{{H}_{2}}O}}=9.3017\)mol/kg; \({{n}_{CO}}=8.7467\)mol/kg;
\({{n}_{{{H}_{2}}}}=8.0255\)mol/kg; \({{n}_{{{N}_{2}}}}=3.0389\)mol/kg;
\({{n}_{HCl}}=5.9422\)mol/kg; \({{n}_{S{{O}_{2}}}}=2.4170\)mol/kg;
\({{n}_{{{O}_{2}}}}=1.1329\times {{10}^{-3}}\)mol/kg; \({{n}_{OH}}=9.9742\times {{10}^{-2}}\)mol/kg;
\({{n}_{NO}}=7.1190\times {{10}^{-3}}\)mol/kg; \({{n}_{H}}=2.7966\times {{10}^{-1}}\)mol/kg;
\({{n}_{Cl}}=1.4281\times {{10}^{-1}}\)mol/kg。
由以上计算可以看出,逐步近似法的要领是将燃烧产物中的组分划分为两组:一组是浓度相对较小的组分,如、OH、NO、H、Cl,称为次要组分。一组是浓度相对较大的组分,如、H2O、CO、H2、HCl、SO2,称为主要组分。首先令次要组分的浓度为零,通过简化了的公式求出主要组分摩尔数的近似值;然后利用主要组分的近似值,通过化学平衡方程计算次要组分的近似值;而后再利用次要组分摩尔数的近似值计算主要组分摩尔数的第二次近似值。如此迭代计算,直到计算结果达到所要求的精度时为止。
下面给出了本算例的C语言程序,以供读者参考。
| /* 说明:此C程序利用平衡常数法计算在给定温度和压强条件下平衡组分 */
#include <stdlib.h> #include <stdio.h> #include <math.h> void main () { double NC,NH,NO,NN,NCl,NS,NAl; //假定化学式中各元素的数量 double n_co2, n_h2o, n_co, n_h2, n_n2, n_hcl;//各组分的摩尔数 double n_o2, n_oh, n_no, n_h, n_cl; //各组分的摩尔数 double n_so2, n_al2o3; //各组分的摩尔数 double n_g; //平衡组分的气相总摩尔数 double Kp_h2o, Kpp_h2o, Kp_h2, Kp_hcl, Kp_no, Kp; //各化学反应式的平衡常数 double NHp, NOp, A, B; //计算中间过程变量 double p,T; //平衡组分计算用的温度(K)和压强(atm) int i; p=100; T=3000; Kp=7.3820; Kp_h2o=0.4628E-1; Kpp_h2o=0.4841E-1; Kp_h2=0.2475E-1; Kp_hcl=1.7070E-2; Kp_no=0.1472E-1; NC=10.120; NH=40.976; NO=27.127; NN=6.085; NCl=6.085; NS=2.417; NAl=0.9259; for(i=0;i<6;i++) //进行6次循环 { if(i==0) //如果是第一次计算,将次要组分的摩尔数设为0 { n_o2=0; n_oh=0; n_h=0; n_cl=0; n_no=0; } else { n_o2=pow(Kp_h2o,2)*pow(n_h2o/n_h2,2)*pow(p/n_g,-1); n_oh=Kpp_h2o*n_h2o*pow(p/n_g,-0.5)*pow(n_h2,-0.5); n_h=pow(Kp_h2,0.5)*pow(n_h2,0.5)*pow(p/n_g,-0.5); n_cl=Kp_hcl*(n_hcl/n_h)*pow(p/n_g,-1); n_no=pow(Kp_no,0.5)*pow(n_n2*n_o2,0.5); } n_n2=0.5*(NN-n_no); n_hcl=NCl-n_cl; n_so2=NS; n_al2o3=0.5*NAl; NHp=NH-n_hcl-n_oh-n_h; NOp=NO-3*n_al2o3-2*n_so2-2*n_o2-n_oh-n_no; A=NOp-NC; B=0.5*NHp-A; n_co2=(pow(pow(Kp*B+NOp,2)+4*(Kp-1)*A*NC,0.5)-(Kp*B+NOp))/2.0/(Kp-1); n_co=NC-n_co2; n_h2o=A-n_co2; n_h2=B+n_co2; n_g=n_co2+n_h2o+n_co+n_h2+n_n2+n_hcl+n_so2+n_o2+n_oh+n_no+n_h+n_cl; printf(“\nLoop: %d\n”,i); //输出每一次的计算结果 printf(“n_o2=%.4e\n”,n_o2); printf(“n_oh=%.4e\n”,n_oh); printf(“n_h=%.4e\n”,n_h); printf(“n_cl=%.4e\n”,n_cl); printf(“n_no=%.4e\n”,n_no); printf(“n_n2=%.4f\n”,n_n2); printf(“n_hcl=%.4f\n”,n_hcl); printf(“n_so2=%.4f\n”,n_so2); printf(“n_al2o3=%.4f\n”,n_al2o3); printf(“n_co2=%.4f\n”,n_co2); printf(“n_co=%.4f\n”,n_co); printf(“n_h2o=%.4f\n”,n_h2o); printf(“n_h2=%.4f\n”,n_h2); printf(“n_g=%.4f\n”,n_g); } return ; } |