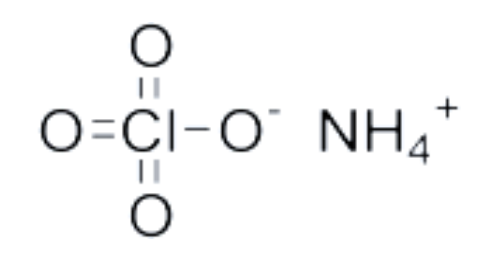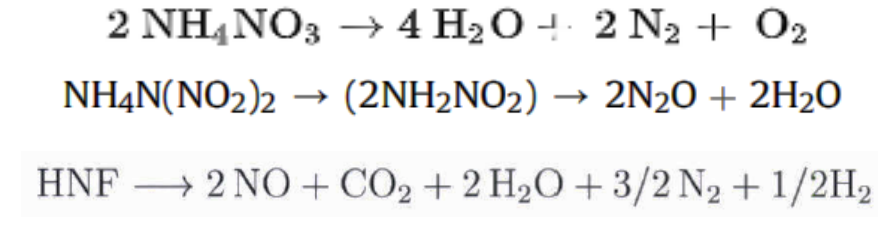环保型氧化剂AN、HNF和ADN
摘要:为了保护环境,当今的立法鼓励开发能导致最小有害影响的材料、物质等。因此,生态友好的概念出现了,并开始在航空航天工程和机械工程(如化肥、建筑材料、能源发电等)不同领域的工程师的工作委员会中占据主导地位。这篇论文的目的是通过现有的文献到目前为止关于发展阶段的环境友好氧化剂,可以在固体推进剂的特定结构中找到。关键词:推进剂,环保型氧化剂,过氯酸铵(AP),硝酸铵(AN),二硝酰胺铵(HNF),硝甲酸肼(ADN)。
简介
分析环境,更准确地说,分析过度和不恰当地使用有利于其生长的材料所造成的污染程度,我们只能得出一个肯定的结论,即生态友好的概念必须成为一个必要的概念。从火箭发动机固体推进剂的典型结构:燃料、氧化剂和粘合剂开始,所有这些元素放在一起必须满足产品必须呈现的三个要求:安全、性能和经济性部分。说到对环境友好的推进剂,我们指的是在其生产过程中使用的那些成分,这些成分在燃烧过程中开发出对生态系统的有害影响最小的产品,但同时赋予至少与目前市场上存在的产品相同的性能,最好甚至超过它们。降低性能将降低有效载荷和增加推进剂消耗,从而对环境产生负面影响。从固体火箭燃料的质量比例来看,氧化剂是至关重要的元素,它是混合物的中心,其他物质围绕着它,以满足上述规定的要求。通常这是环保性格的基础。开发环保推进剂是目前航空航天工程师最渴望实现的方面,通过识别新的氧化剂,能够成功取代非环境友好的氧化剂,如高氯酸铵。良好的绿色高性能推进的候选化合物是硝酸铵(AN),硝基甲酸肼(HNF)和二硝酰胺铵(ADN)。它们正被研究为具有改进性能的未来固体推进剂的环保氧化剂。
二硝酸铵(ADN)是二硝酸的铵盐。ADN在加热下分解,只留下氮气、氧气和水。离子是铵离子NH4+和二硝酰胺N(NO2)2−。
它是一种出色的固体火箭氧化剂,其比冲略高于高氯酸铵,更重要的是,不会留下腐蚀性的氯化氢烟雾。这一特性也具有军事意义,因为无卤烟雾更难检测。它分解成低分子量气体,因此如果用于火炮或火箭推进剂,它有助于提高性能而不会产生过高的温度。盐在高温下比高氯酸盐更容易爆炸和冲击。
EURENCO Bofors公司通过将65%的二硝酰胺铵NH4N(NO 2)2溶解在35%的甲醇和氨水溶液中,生产了LMP-103S作为肼的1对1替代品。LMP-103S 的比冲比单组元联苯高 6%,脉冲密度高 30%。此外,肼具有剧毒和致癌性,而LMP-103S仅具有中等毒性。LMP-103S是联合国1.4S级,允许在商用飞机上运输,并于2010年在Prisma卫星上进行了演示。不需要特殊处理。LMP-103S可以取代肼成为最常用的单组元推进剂。
据报道,与LMP-103S相比,基于ADN的单组元推进剂FLP-106具有改进的特性,包括更高的性能(ISP为259秒对252秒)和密度(1.362克/厘米3对1.240克/厘米3)。
1 非环境友好型与环境友好型
燃烧产物是我们必须考虑到的一个重要问题,当涉及到环境保护。通常,气态产物和固体残留物被测定。在非环境友好型氧化剂中,高氯酸铵(AP)是最大的候选氧化剂。其结构如图1所示。
图1:高氯酸铵的结构
尽管它具有不环保的特性,但历史和专业研究已经表明,就航空航天性能而言,高氯酸铵是最有效的氧化剂。它的效率与燃烧速率有关。然而,它确实有一系列的主要缺点,使他在非环境友好氧化剂的榜上处于领先地位。
图2描述了它的分解反应,在反应产物(氮、氧、水)中很容易观察到氯化氢的出现,氯化氢与水接触后形成盐酸。这种酸会产生烟雾,而且剧毒,还会腐蚀发射台。此外,反应产物对臭氧层有负面影响,增加了全球预警。
图2:高氯酸铵的分解反应13,14
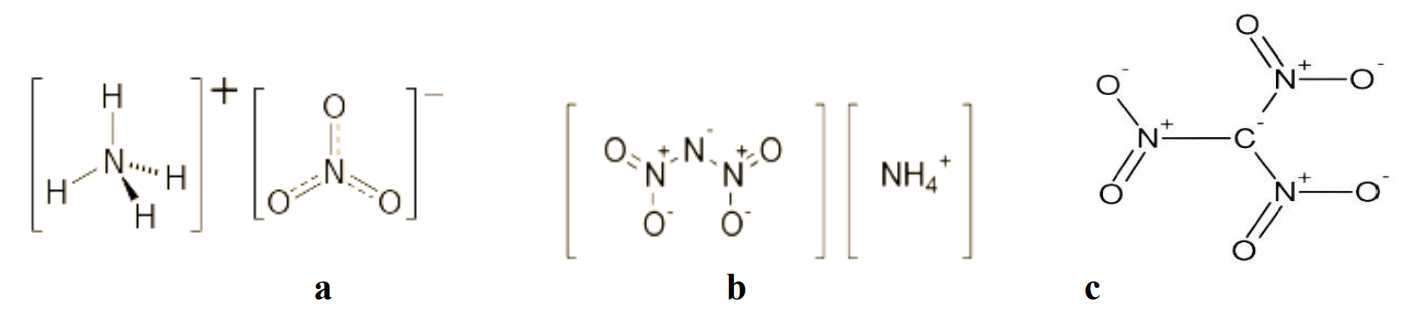
为了克服这些环境问题,该领域的专家已经开始确定能够成功取代高氯酸铵的新化合物,但至少在热力学/能量、动力学和物理化学性质方面具有相同的特性。在这些氧化剂中有硝酸铵、二硝酰胺铵和硝基甲酸肼(图3),它们目前被广泛研究。
图3:AN (a), ADN (b), HNF (c)的结构
这三种物质所具有的环保特性是由图4所示的分解反应所产生的。
图4:AN、ADN和HNF的分解
尽管硝酸铵是一种传统的氧化剂,没有非生态产品,但它具有吸湿性和在实际重要的温度范围内有多个过渡阶段,能量相对较低的缺点。因此,二硝酰胺铵(ADN)和硝基甲酸肼(HNF)作为环保型氧化剂的候选材料,在全球范围内开展了相关研究。与后两者相关,HNF比ADN具有合成方法简单、不吸湿、密度和熔点较高等优点18。考虑到固体火箭推进剂的结构,除了氧化剂,还有其他元素如粘结剂。这种药剂的主要作用是把混合物聚集在基体中。AN、ADN和NHF等高能固体火箭推进剂的发展需要,导致了氮化缩水甘油酯聚合物(GAP)、聚硝甘油酯(PGN)、聚硝甲氧基乙烷(PLN)和3,3-双(氮多甲基)氧基乙烷(BAMO)等高能粘结剂的出现。
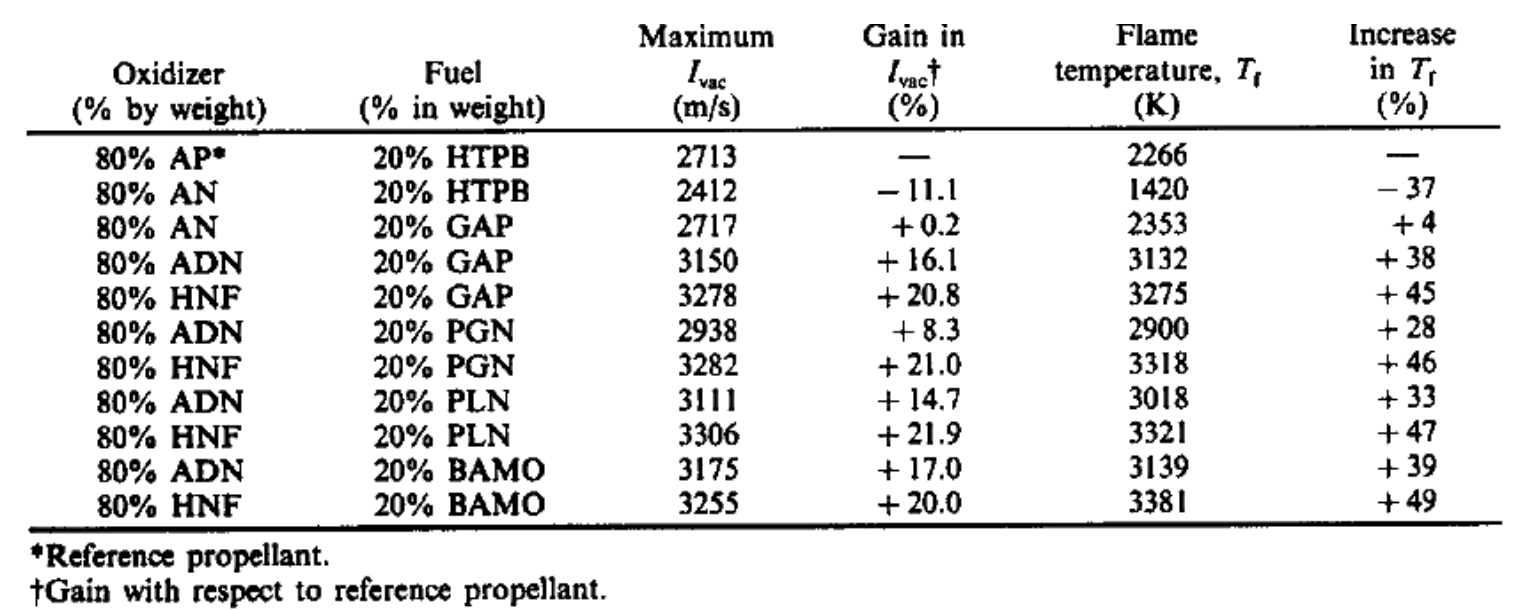
G. Gadiot等人对能量进行了理论研究。在本研究中,我们制作了一系列环保氧化剂和能量粘合剂的组合。所用的质量百分比为氧化剂的80%和粘合剂的20%。表1列出了本研究获得的所选烟型固体推进剂的理论最大性能。
表1:80%氧化剂和20%粘合剂的理论最大性能
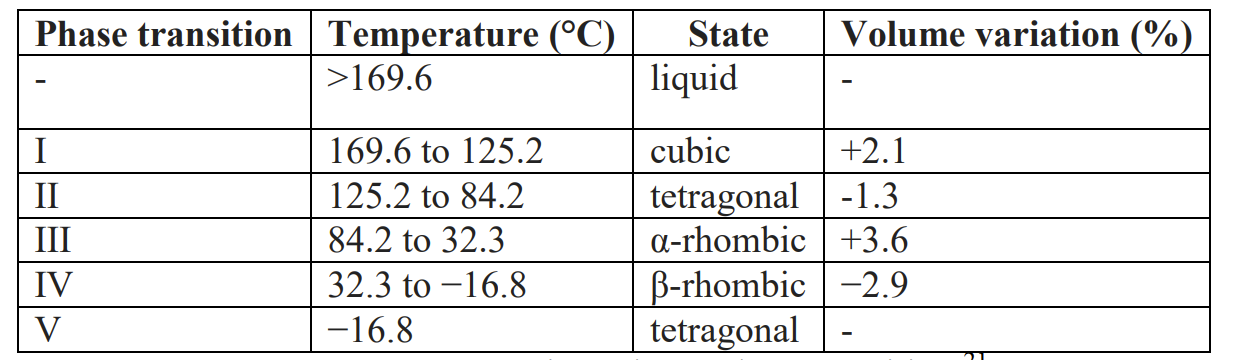
推进剂的设计目的是在一个封闭的室内产生高温和高压,通过分解(燃烧)产生的气体的推进力来加速弹丸、火箭或导弹。由此可见,绿色氧化剂与其他材料的不同组合可以产生很好的效果。即使克服了能量问题,大多数氧化剂也会带来其他问题。例如硝酸铵,除了低能量,它也非常吸湿,经历室温相变(见表2),涉及一个显著的体积变化和燃烧非常缓慢。这些不利的性质使它作为替代氧化剂的吸引力更小。从这里,相稳定硝酸铵(PSAN)的概念开始为人所知。
表2:硝酸铵相变
2 相变,硝酸铵的实验研究
2.1 材料
为获得所需的相稳定硝酸铵,采用硝酸铵(NH4NO3)、硝酸钾(KNO3)和蒸馏水作为溶剂。
2.2 共结晶过程
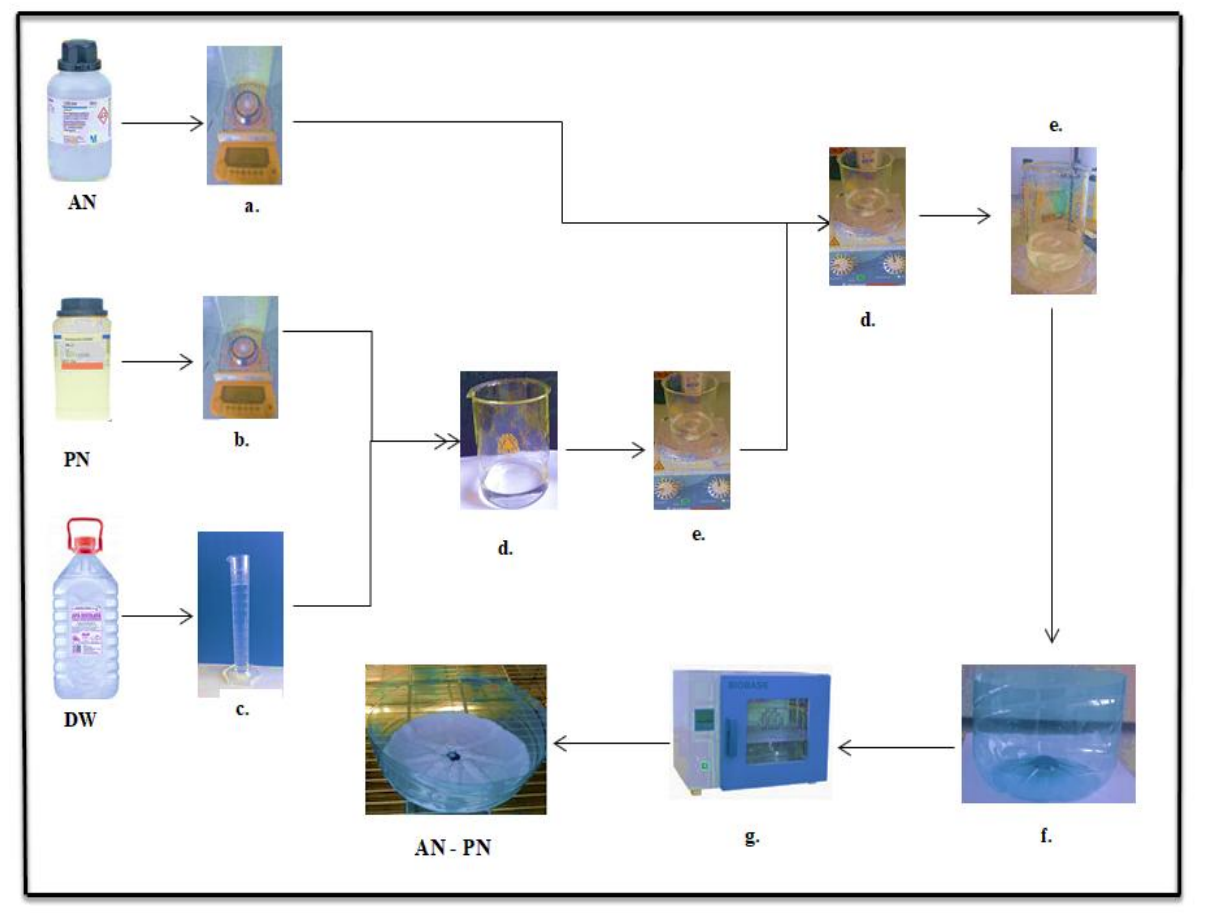
以蒸馏水为溶剂,制备硝酸铵和硝酸钾(PN)的混合物。实验使用的数量为:475克硝酸铵,2.5克硝酸钾和100毫升蒸馏水。用分析天平和刻度圆筒称量后,将混合物置于置于磁铁搅拌器上的600毫升贝塞留斯玻璃中。两种盐在100ml蒸馏水中的溶解过程耗时3小时,磁力搅拌器的转速为500rpm。在完全溶解后,所获得的混合物被放置在一个塑料容器中,随后被引入一个通风干燥炉。混合物在50-80℃的温度下干燥,以便水分蒸发。整个过程持续时间为72小时,所得化合物为硝酸铵和硝酸钾盐(见图4),共结晶反应成功。关于共结晶反应完成的所有阶段如图5所示。
图5:硝酸铵-硝酸钾盐
图6硝酸铵-硝酸钾共结晶过程
(a,b-称重;c -测量;d -混合;e -溶解;f-取样;g干燥)
为了适当地储存所获得的盐,在实验室试验期间在真空干燥器中处理。
2.3 特性
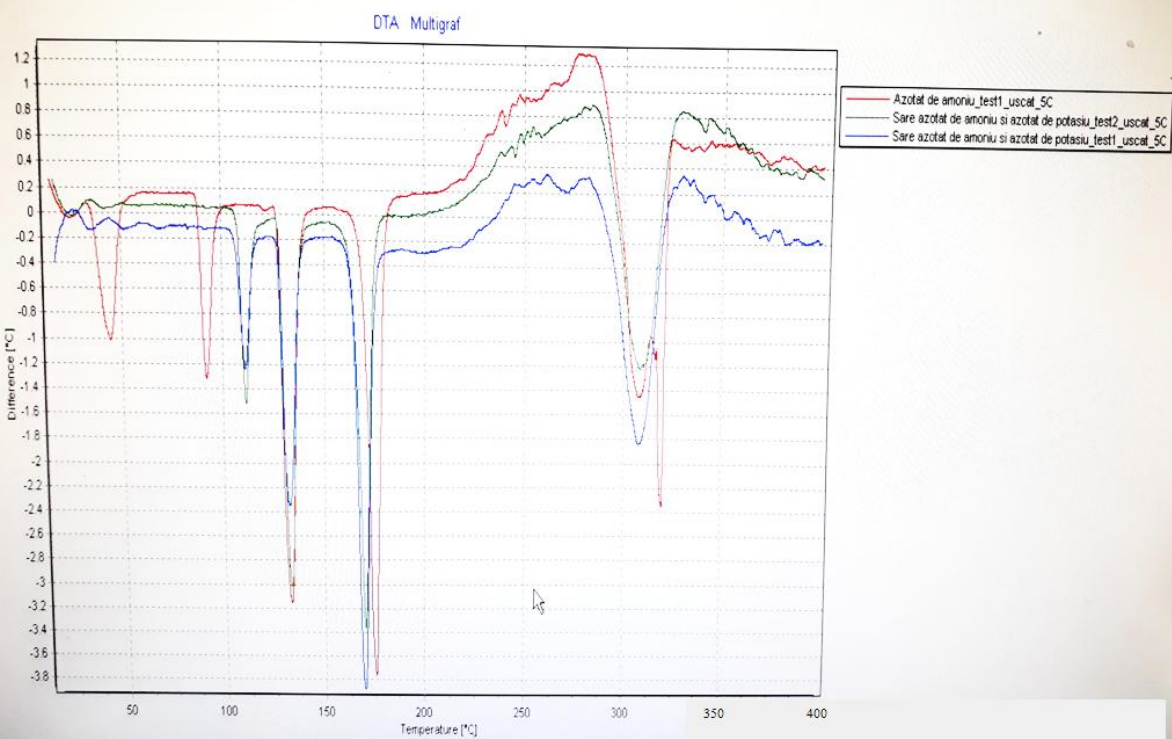
得到盐后,下一步是通过差热分析检查硝酸铵的稳定性,看它是否是PSAN。样品的测试使用dta551 – ex模型,加热速率为5ᴼc。所用样品的大小约为30 mg。
AN各相的转变温度如表2所示。由于相变依赖于样品的纯度,因此所使用的AN采用与本研究中所用的PSAN相同的实验条件进行表征。
图7显示了从室温上升到未处理样品的所有转换阶段。IV-III转变发生在42ᴼC而不是32ᴼC,这并不罕见,因为这种转变已知发生在32到80ᴼC之间的任何地方,这取决于样本的来源。在此转变之后,样品在吸热分解到300ᴼC以上之前还有三次转变。仔细观察PSAN相变,可以观察到通常发生在42ᴼC的转变,在AN的情况下,在协同结晶过程中使用硝酸钾已经消失。共结晶是导致AN19中K+盐形成固溶体的主要原因。
图7:AN和PSAN上的DTA曲线
3.结论
硝酸铵、二硝酰胺铵和硝酸肼等氧化剂合成的复合固体推进剂具有良好的环保性能。然而,当涉及到性能时,这些氧化剂的响应很低,大多数情况下,它们必须与其他成分一起使用,如高能粘合剂,以改善其特性。考虑到所有因素,环保氧化剂是下一步可以作为AP复合固体推进剂的替代品。
参考文献
1. Jisna Jos & Suresh Mathew (2017) Ammonium Nitrate as an Eco–Friendly Oxidizer for Composite Solid Propellants: Promises and Challenges, Critical Reviews in Solid State and Materials Sciences, 42:6, 470-498, DOI: 10.1080/10408436.2016.1244642
2. Shalini Chaturvedi & Pragnesh N. Dave (2013) Review on Thermal Decomposition of Ammonium Nitrate, Journal of Energetic Materials, 31:1, 1-26, DOI: 10.1080/07370652.2011.573523
3. G. da Silva, S. C. Rufino, and K. Iha (2013). Green propellants oxidizers, J. Aerosp. Technol.Manag. 5, 139
4. P. Ding, H. Wang, L. Wen, G. Cheng, C. Lu, and H. Yang, (2014). Studies on synthetictechnology and reduced sensitivity technology of hydrazinium nitroformate, Ind. Eng. Chem.Res. 53, 13851
5. M. J. Tummers, A. E. D. M. van der Heijden, and E. H. van Veen, (2012). Selection of burningrate modifiers for hydrazinium nitroformate, Combust. Flame 159, 882
6. E. Landsem, T. L. Jensen, F. K. Hansen, E. Unneberg, and T. E. Kristensen (2012).Mechanical properties of smokeless composite rocket propellants based on prilled ammonium dinitramide,Propellants Explos. Pyrotech. 37, 691
7. https://en.wikipedia.org/wiki/Ammonium_perchlorate
8. YU, Z., CHEN, L., LU, L., YANG, X., & WANG, X. (2009). DSC/TG-MS Study on in SituCatalytic Thermal Decomposition of Ammonium Perchlorate over CoC2O4. Chinese Journal ofCatalysis, 30(1), 19–23. doi:10.1016/s1872-2067(08)60087-x
9. Fong, C. W., & Smith, R. F. (1987). The relationship between plateau burning behavior andammonium perchlorate particle size in HTPB-AP composite propellants. Combustion andFlame, 67(3), 235–247. doi:10.1016/0010-2180(87)90099-x
10. Al-Harthi, A., & Williams, A. (1998). Effect of fuel binder and oxidiser particle diameter onthe combustion of ammonium perchlorate based propellants. Fuel, 77(13), 1451–1468.doi:10.1016/s0016-2361(98)00059-3
11. Oommen, C. and S. R. Jain. 1999. Journal of Hazardous Materials, 67: 253–281.
12. Kohga, M. and Y. Hagihara. 1998. Propellants, Explosives, Pyrotechnics, 23: 182–187.
13. Boldyrev, V. V. (2006). Thermal decomposition of ammonium perchlorate. ThermochimicaActa, 443(1), 1–36.doi:10.1016/j.tca.2005.11.038
14. Jacobs, P. W. M., & Whitehead, H. M. (1969). Decomposition and combustion of ammonium perchlorate. Chemical Reviews, 69(4), 551–590. doi:10.1021/cr60260a005
15. Venkatachalam, S., Santhosh, G., & Ninan Ninan, K. (2004). An Overview on the Synthetic Routes and Properties of Ammonium Dinitramide (ADN) and other Dinitramide Salts.Propellants, Explosives, Pyrotechnics, 29(3), 178–187. doi:10.1002/prep.200400043
16. Kumar, P. (2018). An overview on properties, thermal decomposition, and combustion behavior of ADN and ADN based solid propellants. Defence Technology. doi:10.1016/j.dt.2018.03.009
17. Dendage, P. S., Sarwade, D. B., Asthana, S. N., & Singh, H. (2001). Hydrazinium nitroformate (HNF) and HNF based propellants: A review. Journal of Energetic Materials, 19(1), 41–78.
18. H.F.R. Schoyer, A.J. Schnorhk, P.A.O.G. Korting, P.J.Van Lit, J.M. Mul,G.M.H.J.L. Gadiot,and J. J. Meulenbrugge. (1995). J. Propul. Power, 11(4) 856
19. Oommen, C., & Jain, S. R. (1999). Journal of Thermal Analysis and Calorimetry, 55(3), 903–918. doi:10.1023/a:1010146203523
20. Gadiot, G. M. H. J. L., Mul, J. M., Meulenbrugge, J. J., Korting, P. A. O. G., Schnorkh, A. J.,& Schöyer, H. F. R. (1993). New solid propellants based on energetic binders and HNF. Acta Astronautica, 29(10-11), 771–779. doi:10.1016/0094-5765(93)90158
21. Kalev, K.G., Thermodynamic and gas dynamics processes in engineering practice, Shumen,2017 г., ISBN 978-954-9681-78-9
22. https://ro.wikipedia.org/wiki/Azotat_de_amoniu