第四章 固体火箭冲压发动机燃气发生器
4.1 燃气发生器的特点
固体燃气发生器就是一个固体火箭发动机。对于工作过程的研究以及性能﹑内弹道计算和设计等各个方面都可以参照固体火箭发动机相似的方法和经验【5】~【7】。但是固体燃气发生器作为固体固体火箭冲压发动机的一个部件又区别于一般的固体火箭发动机。概括来说,固体燃气发生器有如下一些特点:
(1) 燃气发生器的主要功用之一是产生高温高速的燃气射流。这股燃气射流不直接喷入大气以产生推力,而是喷入引射掺混补燃室,与进气道一起形成了一个引射器装置,使从进气道进来的空气(被引射气流)与主动燃气射流进行掺混增压。所以燃气发生器的功用之一是:为引射掺混补燃室提供主动射流。
从燃烧的角度来看,燃气发生器的另一个主要功用是:将固体燃料变为气体燃料,为引射掺混补燃室提供补燃的气体燃料。
(2) 燃气发生器在设计方面也有一些特点。正因为燃气发生器是一个部件,为了组合发动机整体的合理设计,提出了燃气发生器的工作应与其他部件相互协调的问题。因此燃气发生器的设计除了具备一般固体火箭发动机的共性以外,还有自己的一些特点。例如参数选择方面,尾喷管出口界面静压就要考虑到与进气道出口界面静压相协调。结构设计方面也要考虑到掺混过程和补燃过程的要求,以及与其他部件结构协调问题。
(3) 燃气发生器往往采用贫氧推进剂,这是区别于一般固体火箭发动机的又一个重要特点。
诚然,有的空气加力火箭采用一般的固体推进剂(一般固体推进剂都稍稍贫氧),但是引人注目的也是着重研究的是采用贫氧固体推进剂的燃气发生器。
固体贫氧推进剂的贫氧程度区别于一般固体推进剂。它很大程度的贫氧,这是组合发动机工作的需要。固体贫氧推进剂燃烧后生成的燃气大部分是未完全燃烧的中间产物,包括悬浮在燃气中的未燃的金属微粒。从发生器喷口排出的燃烧产物成为第一次燃烧产物。一次燃烧产物在引射掺混补燃室中与空气中的氧继续进行燃烧,称为第二次燃烧或补燃。所以要求发生器的第一次燃烧产物具有一定的均匀性﹑避免金属微粒的烧结等现象。
由于贫氧程度较大,固体贫氧推进剂的性能和燃烧过程都将具有自己的特点。
4.2 固体贫氧推进剂
具有低的氧化剂含量和高的金属燃烧剂含量是固体贫氧推进剂的特点之一。在贫氧推进剂的点火燃烧过程中,由于缺氧产生不完全燃烧的燃烧产物。这同一般的固体火箭推进剂也有较大的区别,因此将给发生器的工作带来了一些新的特点。
这里,我们介绍几个问题:固体贫氧推进剂燃烧过程中的基本物理化学参数;对固体贫氧推进剂的基本要求:固体贫氧推进剂的配方和组分介绍。
4.2.1 固体贫氧推进剂在燃烧过程的基本物理化学参数
我们可以人为地将固体贫氧推进剂在燃烧过程中的物理化学参数分成两组。第一组是贫氧推进剂在发生器中进行第一次燃烧时所采用的物理化学参数:
暴热Qr——一千克级定组分的固体贫氧推进剂在发生器中燃烧所放出的热量。
Tr*——固体贫氧推进剂的燃烧温度。作为一次近似可以认为它是燃气发生器喷管排出的燃烧产物的总温。
Rr,kr,μr——固体贫氧推进剂燃烧产物的气体常数﹑比热容比和分子量。由于贫氧推进剂中含有大量的金属燃烧剂,它的燃烧产物中必夹带有大量的固态或液态(凝聚相)金属氧化物和未燃的金属微粒。这种流体称为二相流体。因此一次燃烧产物的Rr,kr,μr应考虑二相效应的影响。这个问题在第六章(尾喷管)中有稍微详细地说明。
C*——特征速度。
\({{C}^{*}}=\frac{\sqrt{{{R}_{r}}{{T}_{r}}^{*}}}{{{\Gamma }_{r}}}\)
\({{\Gamma }_{r}}=\sqrt{{{k}_{r}}}{{\left( \frac{2}{{{k}_{r}}+1} \right)}^{\frac{{{k}_{r}}+1}{2\left( {{k}_{r}}-1 \right)}}}\)
注意:此处Rr的因次是kJ/kg.K。
特征速度与温度Tr*和比热容比有关,它是反映推进剂在燃气发生器中燃烧过程的一个特性参数。由于推进剂贫氧燃烧不完全,故它的C*和一般固体火箭发动机的比较,其值很低。
Isr——燃气发生器的比冲。它可以由一次燃烧生成的燃气从发生器流出的条件计算而得,或者采用弹道摆来实测。Isr在计算时都应当考虑二相流动效应。
第二组参数是燃气发生器中流出的不完全燃烧产物进入混燃室同空气中的氧进行补燃时的一些物理化学参数:
Qbr——补燃热值,它是一千克推进剂的一次燃烧产物在混燃室中与空气中的氧进行补燃后释放出来的热量。
Hu——推进剂的低热值,即一千克推进剂完全燃烧所散出的热量,应该指出推进剂的热值有高热值与低热值之分。推进剂的高热值包括了燃烧产物中水蒸气全部凝结成水的凝结热(或水的汽化热),而低热值中不包括水蒸气的凝结热。在固体火箭——冲压组合发动机的实际工作条件下,燃烧产物在水蒸气不能凝结的高温下已从喷管中排出,因此水蒸气的的凝结热不会被我们所利用。
\({{H}_{u}}={{Q}_{r}}+{{Q}_{br}}\) (4-1)
Hu是一千克推进剂全部可用的能量。
为了衡量推进剂的贫氧程度,可用推进剂余氧系数α表征。α定义为推进剂实际氧含量与完全燃烧需氧量之比。
Lo——理论空气量,或称恰当混合比,即完全燃烧一千克贫氧推进剂所需要的理论空气量,也是一千克推进剂的一次燃烧产物完全燃烧所需的最少空气量。
α——余气系数(余氧系数),即单位时间进入混燃室的实际空气量\({{\dot{m}}_{k}}\)千克和完全燃烧\({{\dot{m}}_{k}}\)千克推进剂所需的\({{L}_{O}}{{\dot{m}}_{r}}\)之比
\(a=\frac{{{{\dot{m}}}_{k}}}{{{L}_{{}^\circ }}{{{\dot{m}}}_{r}}}\)
式中 \(\frac{{{{\dot{m}}}_{k}}}{{{{\dot{m}}}_{r}}}=N\) 并称N为引射系数,
因此 \(\alpha =\frac{N}{{{L}_{O}}}\) 或 \(N=\alpha {{L}_{O}}\) (4-2)
如果设定推进剂中F、Cl等(假定存在的情况)先满足当量化合,则可导出α与理论空气量Lst,1kg推进剂中氧的含量n0(mol)的关系式:
\(\alpha \text{=}\frac{1}{14.5\frac{{{L}_{O}}}{{{n}_{0}}}+1}\)
固体火箭冲压发动机贫氧推进剂的余氧系数α的值约为0.05~0.3。低值对应于高热值碳氢贫氧推进剂,α=0.18~0.30的范围对应于中等热值镁铝贫氧推进剂。一般的固体火箭发动机推进剂,也属负氧平衡,α≥0.5~0.6。
理论空气量值Lo可以计算如下:
推进剂中燃烧元素完全燃烧时典型的化学方程式为
C+O2→CO2
2H2+O2→2H2O
4Al+3O2→2Al2O3
2Mg+O2→2MgO
4B+3O2→2B2O3
2Be+O2→2BeO
4Li+O2→4Li2O
令[C],[H],[Al],[Mg]…为一千克推进剂中相应元素的含量
[O]为一千克推进剂中氧元素的含量
\({{m}_{C}},{{m}_{H}},{{m}_{Al}},{{m}_{Mg}}\cdots {{m}_{O}}\)为相应元素的原子量,完全燃烧一千克推进剂所需纯氧气的数量用MO表示,则
\({{M}_{0}}=\frac{2{{m}_{O}}}{{{m}_{C}}}\left[ C \right]+\frac{{{m}_{O}}}{2{{m}_{H}}}\left[ H \right]+\frac{3{{m}_{O}}}{2{{m}_{Al}}}\left[ Al \right]+\frac{{{m}_{O}}}{{{m}_{Mg}}}\left[ Mg \right]+\cdots \cdots -\left[ O \right]\)
即
\({{M}_{0}}=\frac{8}{3}\left[ C \right]+8\left[ H \right]+\frac{8}{9}\left[ Al \right]+\frac{2}{3}\left[ Mg \right]+\cdots \cdots -\left[ O \right]\) (4-3)
空气中含有重量百分比为23.3%的氧,因此为完全燃烧一千克推进剂所必需的理论空气量为:
\({{L}_{O}}=\frac{{{M}_{0}}}{0.232}\) (4-4)
由(4-3)(4-4)式可知,当推进剂中粘合剂(炭氧化合物)含量较大时,LO值增大;金属元素完全燃烧所需的氧较碳或氢元素完全燃烧所需的氧要少一些。推进剂本身含氧量增加,则LO值减少。
这两组参数都与推进剂的配方有关,在讨论贫氧推进剂性及其燃烧过程时,经常要涉及它们。
4.2.2 对固体贫氧推进剂的基本要求
为了使火箭——冲压组合发动机得到好的性能指标,在设计中对固体贫氧推进剂提出下面一些要求。
(1)要求固体贫氧推进剂具有较高的热值。或者更直接的说,要求它具有高的比冲。因为\({{I}_{s}}\sim \sqrt{{{H}_{u}}}\),显然Hu增大在其他条件相同的情况下,Is也增大,这对于提高固体火箭——冲压组合发动机的战术技术性能和经济性是有利的。例如比冲达到Is=8000-9000m/s,则在导弹上采用这种发动机就将充分显示出它的优越性,这时贫氧推进剂的热值应为Hu=29.26-37.62MJ/kg左右。但是提高贫氧推进剂的热值一方面受到推进剂组分的限制,另一方面也受到发动机设计方面因素的制约。
为了提高推进剂的热值可以采用高热值的燃烧元素和化合物,但是在具体情况下受到了比重﹑毒性﹑物理与化学安定性﹑相容性以及推进剂的工艺性﹑力学性能等方面的限制,实际上可以选用的并不多。如果采用高热值的金属元素为燃烧剂,还要考虑到二相流动效应的限制。
为了提高贫氧推进剂的热值可以降低贫氧的程度。但是为了保证燃气发生器的正常工作,贫氧推进剂仍须保证最低限度的含氧量,例如余氧系数不小于0.2-0.3(余氧系数是推进剂的重要参数之一,它是推进剂中实际含氧量与推进剂中可燃元素完全燃烧所需含氧量值比)余氧系数小于这个限度,燃气发生器的点火和贫氧推进剂的燃烧就难以维持了。此外,也往往采用热值不高,着重提供活性氧的氧化剂。这些都限制了推进剂热值的提高。
降低贫氧程度,采用高热值的燃烧元素和化合物提高推进剂的热值以后,应当综合考虑到结构方面的影响。热值Hu大,一般T4*也高。为了防止发动机部件在高温气流下的过热和烧蚀,有时有必要限制T4*的最大值。因为(在简化条件下)
\({{T}_{4}}^{*}={{T}_{br}}^{*}=\frac{\alpha {{L}_{O}}}{1+\alpha {{L}_{O}}}{{T}_{H}}^{*}+\frac{\varphi {{H}_{u}}}{\left( 1+\alpha {{L}_{O}} \right){{C}_{pbr}}}\)
为了限制T4*,当Hu增大时,要求αLO也增大。αLO增大,将使空气比冲下降(每千克空气所得到的比冲,其值为Is/αLO)对于一定推力的发动机来说,将使\[{{\dot{m}}_{K}}\]增大,发动机的尺寸增大,因而使发动机的阻力增大。在设计时,这个因素也应当考虑到。
(2) 要求固体贫氧推进剂具有较大的比冲。或者与热值的要求结合起来说,要求它具有高的密度比冲。这样可以减小燃气发生器的容积及结构重量。对结构要求十分紧凑的低阻力导弹,对尺寸受到限制的机载或舰载导弹,推进剂比重的提高更为重要。对于飞行器的质量比(即飞行器起飞重量与发动机燃烧结束后飞行器的重量之比)相对较小时,提高推进剂密度与提高推进剂比冲的效果几乎是一样的。但是对于现在的一般固体推进剂来说,常常是当推进剂密度增加时比冲趋于减小,因此采用密度比冲(ρpIs,ρp是推进剂的密度)作为统一的技术指标。现在一般固体火箭推进剂的比重为1600-1850kg/m3左右,贫氧推进剂也应在这个范围内。有时为了改善贫氧推进剂的其他性能,往往需要添加一些比重小的元素,可能使贫氧推进剂的比重稍有降低。如果这样做能使推进剂所提供的能量在实际燃烧过程中能够有效的释放,实际比冲将会提高,对推进剂密度的要求也不要过分追求。
(3) 对燃烧速度的要求。发动机总体设计规定了燃气发生器的流量\[{{\dot{m}}_{r}}\]和工作时间tk。在选定了发生器燃烧时压力pr*和推进剂初温以后,就可以着手装药设计了。装药设计中药型的选择跟贫氧推进剂的燃速有非常密切的关系,采用侧面燃烧还是端面燃烧要求燃速数值有很大差别。
在直径受到限制而发动机工作时间较长的条件下,若采用侧面燃烧,要求推进剂的燃速是很低的,约为r=2-2.5mm/s左右。例如弹径为335mm,工作时间40秒,要求推进剂的线燃速约为2左右。若采用端面燃烧,要求推进剂的线燃速r=12-17mm/s左右。因此贫氧推进剂应有高燃速和低燃速二种类型。
贫氧推进剂和一般火箭推进剂一样,燃速的压力指数和温度敏感系数都应尽可能的低。因为若燃速随装药初温和燃烧室压力作过大变化,不仅影响了推力,而且将影响冲压通道工作的协调,使发动机的性能降低甚至破坏工作,例如使进气道的防喘裕度减小或者造成亚临界工况的出现。
(4) 要求贫氧推进剂在发生器中产生的一次燃烧产物具有良好的与空气中的氧进行反应的能力。这就是说,要求一次燃烧产物尽可能是气相的﹑均匀的,没有烧结等现象。因为一次燃烧产物的状况对之后的补燃过程有很大影响,如果补燃效率很低将使发动机比冲严重下降。
(5) 要求贫氧推进剂的物理化学安定性好,机械强度高﹑工艺性好﹑成本低﹑制造与处理安全﹑能长期保存等。这方面的要求与一般固体推进剂是一样的。贫氧推进剂的极限抗拉强度σm与复合药差不多。比双基药要小得多。
(6)要求推进剂具有较高的一次燃烧喷射效率。
含金属富燃推进剂具有低氧化剂含量、高金属含量特点,一次燃烧产物中凝聚相组分的含量很高(超过70%),当燃速较低时,少量的气体产物很难将凝聚相“带出”燃气发生器并喷射入补燃室中,因此燃气发生器中凝聚相产物的沉积不可避免。一般用喷射效率表征推进剂在一次燃烧过程中燃烧产物喷射入补燃室内程度。喷射效率定义为:
\(\eta =\frac{{{M}_{C}}}{{{M}_{\Pr }}}\)
MC:完全喷射入补燃室内的一次燃烧产物总质量
MPr:富燃推进剂总质量
在实际计算过程中,常常用燃气发生器工作前后总质量差表征MC的大小,这种处理方法忽略了富燃推进剂外表衬层、包覆层以及发动机绝热层的烧蚀,因此计算结果比实际喷射效率略高。
低的喷射效率将会对冲压发动机的燃烧产生很强的负面影响,一方面是因为沉积物主要是碳和未燃烧的金属及金属的化合物,它们所含能值很高,因此沉积物的存在使推进剂潜在的能量不能完全发挥出来,明显降低了它的燃烧效率;另一方面,燃气发生器中的沉积物对发动机的安全工作造成了严重的威胁:沉积物是以结块状沉积于燃气发生器中,可能会堵塞喷射装置,轻者会引起燃气发生器内的压强变化,降低补燃效率,重者可能会破坏燃气发生器,产生严重的后果。
影响含金属富燃推进剂一次燃烧喷射效率主要有两大因素:推进剂配方及燃气发生器喷射装置。
如果含金属富燃推进剂配方设计不合理,如氧化剂含量过少,金属粒径不合适等,则推进剂燃烧时在燃面处容易产生结团,或形成残渣骨架。含铝富燃推进剂中金属铝在燃气发生器工作过程中很容易结团,导致结团铝在燃气发生器喷喉处发生沉积;对含硼富燃推进剂燃烧沉积物分析发现,当硼结团粒径超过360μm时,喷喉处沉积量会显著增加。在富燃推进剂组分调整中,有利于提高推进剂燃速和一次燃烧气相温度的因素基本有利于一次燃烧喷射效率的提高。
采用碳化型绝热材料或钨渗铜作燃气发生器喷管喉衬,可减少喷管喉部沉积;喷射装置采用多喷管结构,一方面可使排出的富燃燃气相对分散,与补燃室内空气接触界面增加,同时也可提高一次燃烧喷射效率。目前应用较多的为半球型多喷管。
从实验结果来看,燃气发生器采用非壅塞式结构,相对壅塞式结构,喷射效率可获得较大提高。目前,国内含铝富燃推进剂一次燃烧喷射效率已接近99%;而含硼富燃推进剂的一次燃烧喷射效率也超过了97%。
在提出推进剂的要求时,应当与发动机的具体任务结合起来,全面考虑,综合分析。
4.2.3 贫氧推进剂的组分
固体贫氧推进剂由氧化剂﹑粘合剂﹑以及各类添加剂等组分所组成。其主要组分与固体复合推进剂的主要组分相同,因此有关复合推进剂的许多研究成果完全可以借鉴。当然,由于贫氧推进剂的燃烧条件不同,对它的组分和配方也有一些新的特点。
(1) 氧化剂 贫氧推进剂中氧化剂的作用主要是提供贫氧推进剂可靠点火与维持正常燃烧所必需的氧。对于贫氧推进剂来说,希望减少氧化剂的含量,当然这也是有一定限度的,氧化剂含量过少会使燃气发生器中的燃烧过程不能正常进行。对于以利用冲压空气补燃,提高发动机比冲为主的火箭冲压发动机,贫氧推进剂中的氧化剂含量大致为25%~40%。这个含量比起一般火箭发动机用固体复合推进剂的氧化剂含量(≥70%)低了许多,而推进剂中的燃料含量(包括作为粘合剂的碳氢燃料、粉状的金属燃料)却增加了。贫氧推进剂的燃料含量可以达到55%~75%。显然,贫氧推进剂能量指标(热值)的提高,一方面依靠采用高能(高热值)燃料,另一方面则通过减少氧化剂含量达到。
氧化剂的选择是根据其生成焓﹑密度﹑有效含氧量以及物理化学安定性等各方面因素选取的。生成焓应尽可能接近于正值(或就是正值),密度和有效含量都应可能的大。可以作为氧化剂的有硝酸盐和过氯酸氨盐等物质,表4-1列出了某些氧化剂的性能。
表4—1 某些氧化剂的性能表
| 氧化剂 | 分子式 | 分子量 | 密度(kg/m3) | 可用氧% | 生成焓 kJ/mol | |
| 硝酸钠 | NaNO3 | 89 | 2260 | 47.0 | -424.27 | |
| 硝酸钾 | KNO3 | 101.1 | 2110 | 39.5 | -492.404 | |
| 硝酸铵 | NH4NO3 | 80.05 | 1725 | 20.0 | -364.914 | |
| 硝酸肼 | N2H5NO3 | 90.0 | 1685 | 8.4 | -246.62 | |
| 硝酸锂 | LiNO3 | 68.85 | 2320 | 58.02 | -481.954 | |
| 过氯酸铵 | NH4ClO4 | 117.49 | 1950 | 34.04 | -290.092 | |
| 过氯酸锂 | LiClO4 | 106.4 | 2430 | 60.15 | -409.64 | |
| 过氯酸硝酰 | NO2ClO4 | 145.46 | 2220 | 66 | 33.44 | |
| 过氯酸钾 | KClO4 | 138.55 | 2520 | 46.19 | -433.048 | |
| 过氯酸肼 | N2H5ClO4 | 132.49 | 1960 | 24.2 | -177.65 | |
钠盐吸湿性大,KNO3燃烧时发生浓烟,生成焓又低,不适宜作为推进剂组分。过氯酸硝酰的生成焓是吸引人的,但是这种氧化剂同燃烧剂之间的反应过于剧烈,因此无法安全使用,只有利用比如说由氯衍生氧化粘结剂把氧化剂颗粒同粘粘剂隔开来才可能采用。硝酸肼的有效含氧量(可用氧)很低,而对于贫氧推进剂的氧化剂来说,有效含氧量是很重要的的指标。过氯酸钾的有效含氧量是过氯酸氨的1.3倍,如果采用过氯酸钾代替过氯酸氨,既可以进一步减小贫氧推进剂中氧化剂的含量。例如,用过氯酸氨为氧化剂时,含量在30%以上才能正常燃烧。而用过氯酸钾为氧化剂时,含量在20%以上就能正常燃烧。当然过氯酸钾也有它的缺点,例如,燃烧产物中有凝聚相产物,有烟,冲击感度大。
在贫氧推进剂中氧化剂的含量对推进剂性能的影响很大。由表4-2可以看到,某推进剂中过氯酸氨含量变化引起和热值Hu变化的情况。
表4—2
| 推进剂性能 | NH4ClO4含量 % | |||||
| 30 | 40 | 60 | 70 | 80 | 85 | |
| 理论空气量LO | 9.95 | 8.25 | 5.03 | 3.42 | 1.78 | 0.97 |
| 热值HUkJ/kg | 29970.6 | 25539.8 | 19186.2 | 14880.8 | 10659 | 8610.8 |
在贫氧推进剂中,由于氧化剂的含量减少了,因此氧化剂性能对整个推进剂的影响也减少了,因此氧化剂性能对整个推进剂的影响也减少了。例如对于热值来说,采用NH4ClO4或NH4NO3﹑或KClO4,推进剂的热值相差不多,如表4-3所示。
表4—3
| 氧化剂含量% | 粘合剂含量% | 热值HUkJ/kg | |||
| NH4NO3 | 20 | 端羟基聚丁二烯 | 80 | 36830 | |
| NH4ClO4 | 20 | 端羟基聚丁二烯 | 80 | 33792 | |
| KClO4 | 20 | 端羟基聚丁二烯 | 80 | 33577 | |
结合各种因素进行分析比较,可供选择的氧化剂并不多,其中最常用的还是NH4ClO4。因为从各项性能指标来看,NH4ClO4作氧化剂是比较好的,它的生成焓比较高(接近于零),密度也相当大,压力指数低,成气性好,燃烧产物中不生成固体氧化物,不产生浓烟,它在贫氧推进剂中得到广泛采用,但是它的吸湿性较大。其次例如KClO4,虽然成气性差(生成KCl固体颗粒),但它的比重大,吸湿性小,有效含氧量大,故引起了人们的注意。
(2) 粘合剂:粘合剂是贫氧推进剂中的另一重要组分。在贫氧推进剂中,固体添加剂的含量常常很高,因此要求粘合剂有很高的粘合能力,以粘合固相成分保证装药的力学性能。同时,它在推进剂中还作为燃料,因此采用高热值的粘合剂,也是提高推进剂能量的一个途径。
粘合剂的选择是根据其热值高、燃烧产物的平均分子量低(粘合剂最好由低原子量的原子组成)、粘合能力强、密度大、工艺性好等各方面因素来选取的。
(3) 添加剂:加入添加剂的主要目的是为了提高推进剂的热值,提高它补燃后的燃烧温度,提高发动机的比冲。常用的添加剂有碳氢化合物、轻金属以及金属氢化物等。
碳氢化合物的热值高,成气性好,其中蒽、黑索金、奥克托金等大有希望。蒽的升华点高,为了改善推进剂的力学性能可以考虑用半补强炭黑为补强添加剂。黑索金、奥克托金比重大、热值高,是贫氧推进剂中很有希望的添加剂,其主要缺点是使推进剂的力学性能有所下降,工艺上有一定困难,此外应用于组合发动机中最重要的缺点是它们必需在高的燃烧室压力下,才能显示出其高能的优点,为了避免点火压力峰,尚需采取一些措施。
常用的金属添加剂有铝粉、镁粉、铍粉和硼粉等,它们的一些性能列于表4—4和4—5中。
表4—4 某些金属的性能
| 金属 | 密度 kg/m3 | 原子量 | LO | HUkJ/kg | 熔点 K | 沸点 K |
| 铝Al | 2700 | 26.98 | 3.84 | 31141 | 932 | 2740 |
| 镁Mg | 1740 | 24.31 | 2.34 | 24871 | 923 | 1381 |
| 铍Be | 1850 | 9.01 | 7.65 | 67757.8 | 1556 | 2750 |
| 硼B | 2340 | 10.81 | 9.56 | 58938 | 2570 | 2820 |
表4—5 金属氧化物的熔点和沸点
| 金属氧化物 | 熔点 K | 沸点 K |
| Al2O3 | 2318 | 3800 |
| MgO | 3075 | 3350 |
| BeO | 2823 | 4123 |
| B2O3 | 723 | 2158 |
在一般的固体推进剂中,金属添加剂的含量大约为10%~15%,在贫氧推进剂中金属添加剂的含量更高,达到30%~40%,甚至可能更高。
在上述金属中,铍粉的能量最高,但是铍及其氧化物BeO都是极毒的物质,并且资源稀缺,价格昂贵,在一定程度上限制了它作为推进剂的成分。镁的能量水平不太高,而且密度也太小,但是镁的LO值小,而且加入少量(5%左右)的镁对贫氧推进剂的点火大有好处。硼的能量水平较高,密度也较大,但是理论空气量LO值较大。铝的各方面性能都不错,所以目前使用最广泛的还是铝粉。
最近金属氢化物引起人们的注意,其中Al、B的氢化物热值很高,例如AlH3的生成热为—380.4kJ/kg,密度为1300—1600kg/m3,由于它含有H,所以降低燃烧产物的分子量,但是它的化学活性大,与其他成分的相容性问题比较严重,易于分解,安定性差,这些问题有待进一步解决。贫氧推进剂的增塑剂、固化剂、安定剂、催化剂等均与一般固体火箭推进剂的要求相类似,这里不再重复。
4.3 固体贫氧推进剂的燃烧问题
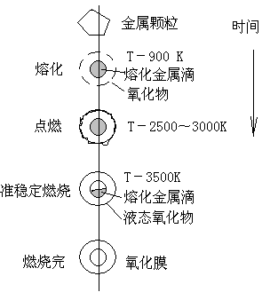
由于贫氧推进剂一般具有低的氧化剂含量和高的金属添加剂含量,使得它的燃烧过程带来一些新的特点。在组合发动机中,因为有空气的氧参与推进剂的燃烧过程,因此贫氧推进剂的燃烧是很自然地分成了两个阶段:在燃气发生器中发生的一次燃烧过程,以及在燃烧室中进行的二次燃烧过程即补燃过程。这是推进剂中贫氧所造成的,也是组合发动机的一个特点。金属添加剂含量高这个特点使得研究金属燃烧问题就成为必要了。看来金属颗粒的燃烧过程既发生在燃气发生器中,也发生在混燃室中,这里对固体贫氧推进剂的一次燃烧过程作粗略的讨论,至于补燃过程在第五章“引射掺混补燃室”中讨论。
4.3.1氧化剂和粘合剂的热分解及其物理化学过程
目前固体贫氧推进剂中的氧化剂仍主要采用高氯酸铵。对于采用高氯酸铵为氧化剂的固体推进剂,其燃烧情况在文献[5]中已经做了介绍,为了加深对贫氧推进剂一次燃烧过程的理解,这里对高氯酸铵的热分解机理再做一些补充说明【1】。
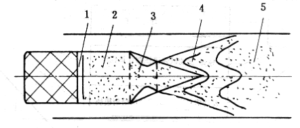
1-氧化剂和粘合剂热解产物气相燃烧区 2-金属颗粒加热和部分易燃金属燃烧区
3-喷管动力过程影响区 4-空气与一次气相可燃物和易燃金属掺混燃烧区
5-难燃金属、碳颗粒等扩散燃烧区
图4-1 燃烧过程分区示意图
在推进剂高度贫氧的条件下,完成良好的一次燃烧比较困难。推进剂燃烧表面附近是燃烧过程的第一区域(图4-1)。对于复合推进剂、氧化剂和粘合剂的热解温度一般不相同(即所谓“两温概念”)。常用的氧化剂NH4ClO4(AP),有较低的热解温度200~410℃(两个反应峰温为297℃和402℃),粘合剂HTPB在320℃开始低温分解,440℃大量热解。在推进剂中,AP和HTPB以混合物存在,且HTPB覆盖AP颗粒表面,它们的分解产物从基体逸出后,即产生燃烧反应,放出大量的热。其中一部分起着加热推进剂表面的作用,形成所谓的“自动热分解”。
现在大部分研究者都认为高氯酸铵的热分解遵循着所谓质子转移机理,认为在晶体表面上首先发生NH4+离子向ClO4–阴离子转移质子H+的过程:
NH4+ClO4–→NH3+HClO4
在低温或高温下的高氯酸铵的热分解是不完全相同的。在温度低于300以下时,称为低温分解阶段,实验表明低温分解反应是晶体表面上吸附着的NH3和HClO4之间的反应。在低温下,由于吸附着的NH3不能全部由HClO4的的分解产物所氧化,所以随着分解过程的进行,NH3将不断地覆盖晶体表面。若NH3覆盖了全部分解表面,分解过程即停止。因此在低温下,高氯酸铵仅能分解30%。
当温度在350~450之间时,称为高温分解阶段。在高温下,HClO4在气相中分解,实验证明这个气相分解反应是整个热分解速度的控制环节。因此,认为在高温下,晶体表面上发生质子转移后生成的NH3及HClO4从晶体上解析入气相,HClO4在气相中分解,生成氧化性产物。NH3在气相中由HClO4的分解产物所氧化,生成最终产物。
2HClO4→H2O+Cl2O7
2Cl2O7→2Cl2+7O2
4NH3+5O2→6H2O+4NO
在高温分解及低温分解期间,都伴随有升华过程。通过实验测得高温下的升华活化能为89.87kJ/mol,分解活化能为125.4kJ/mol,两者数值相近,认为机理也相同,也遵循着质子转移机理。认为首先高氯酸铵在其表面上的半晶位置上,NH4+离子中的质子H+转移至ClO4+上形成了NH3及HClO4,但仍然吸附在晶体上。然后吸附着的NH3和HClO4解析进入气相重新冷凝形成NH4ClO4,这就是升华的过程。
实际上,高氯酸铵是一种单组元推进剂,在一定条件下它可自热燃烧。这种自热维持的燃烧称作爆燃。一些研究者提出固体推进剂的燃速取决于其组分热分解的速度。更具体地说,高氯酸铵在复合推进剂燃烧区中的特性强烈地影响着整个推进剂的燃烧过程,在一定条件下,推进剂的燃速受到高氯酸铵爆燃速度的控制。
粘合剂也是复合固体推进剂的重要组分,它对推进剂的燃烧特性也有重要影响。目前,固体贫氧推进剂所用的粘合剂,主要有聚丁二烯丙烯酸、端羟基聚丁二烯或端羧基聚丁二烯。
聚丁二烯丙烯酸,在615 K时开始低温分解,并开始缓慢地冒泡排气,685K时热解速度增大,725K时热解速度达到最大值。在高温下热解时,其加热表面为液体。
端羧基聚丁二烯,在610K时开始低温分解并开始排气,690 K时成为高黏性液体,热解速度增大,730K时热解速度达到最大值,770K时全部热解。在高加热速度下,迅速熔化。
粘合剂对推进剂燃烧过程的影响说法不一。有的研究者认为粘合剂热分解后向气相提供了新鲜的可燃物质,因而影响了推进剂燃烧的火焰温度。有的研究者认为一般的粘合剂在热解、气化之前都熔化为液体。不同类型的粘合剂,其熔化液的流动性不同,它对燃烧面上的高氯酸铵晶体的覆盖程度不同,从而影响了高氯酸铵的分解过程。有的研究者认为粘合剂在热解时往往产生一定量的固体碳,这些碳与熔化的液体混合在一起。碳的氧化会产生大量的热,同时碳还可以提高火焰区向燃烧表面的传热效率,从而提高了推进剂燃烧表面的温度,加速了高氯酸铵的分解,提高了推进剂的燃速。还有从粘合剂的热解产物对高氯酸铵的催化作用或抑制作用等方面进行分析的。总的说来目前对高氯酸铵热分解的详细步骤、以及粘合剂热解特性及对推进剂燃烧过程的影响研究得还很不充分,许多问题并没有弄得很清楚。
根据气相型燃烧理论认为:气相放热反应(化学反应)发生在燃烧面附近,表面上凝聚相的分解,气化所需的热量全部由气相反应供给。气相区中的反应物是推进剂各个组元各自独立分解,气化后进入气相区的(显然金属颗粒是来不及气化的)。各组元分解产物之间要进行燃烧反应,还需要一个混合过程,以使不同成分的物质均匀混合、互相接触才能发生化学反应。因而气相燃烧过程应包括混合过程和化学反应两个过程;气相反应所需的时间则应包括分子混合过程和化学反应所需的时间。扩散混合所需的时间不仅与扩散速度有关,而且与各种成分原有的不均匀程度有关。而原有的不均匀程度取决于推进剂中各组元的颗粒尺寸,主要是高氯酸铵颗粒的尺寸。颗粒尺寸愈大,气相反应前的不均匀度越大,扩散混合时间愈长。颗粒细,不均匀度愈小,扩散混合时间就愈短。在贫氧推进剂中,由于氧化剂含量很低,氧化剂的分解产物与燃烧剂分解产物之间分布很不均匀。在这种条件下,相对于扩散混合来说,可以认为化学反应速度很快,随着扩散混合的进行,就相应地完成了分子之间的化学反应。因此扩散混合过程成了决定燃烧过程的控制因素。边混合边反应,形成宏观的不均匀的扩散焰。
贫氧推进剂点火后,氧化剂和粘合剂等不断地进行热分解,以维持燃烧反应的正常进行。它们热分解所需要的来自气相反应的反向热流。在固相表面层中,主要由于热传导形成一个自初温到表面温度的一个温度逐渐升高的加热层,认为固相不存在反应层。
如果氧化剂含量减少到一定程度,分解出来的氧很少,此时气相的燃烧反应放出的热量很少,反应热流就很小,难以维持推进剂各组分的继续分解,燃烧反应难以正常进行。假如推进剂中高氯酸铵的含量少于30%时,就将发生断续燃烧或冒烟分解。如果采用过氯酸钾为氧化剂时,其含量在20%就能正常燃烧,因为过氯酸钾的有效含氧量是比较高的,可以有足够的氧参加燃烧反应。
推进剂的初温对燃烧过程有影响,若初温较高,固相中原有的热量较多,在同样的反向热流作用下,燃烧表面的温度升高得更快,因而加速了固相分解速率,使燃速增大。
当前,固体燃气发生器的工作压力大体在4-10MPa范围内。随着压力的增加,火焰前锋更加靠近燃烧表面,此处温度梯度加大。对于多数推进剂来说,其燃速(在一定压力范围内)随压力增加而增大。
在氧化剂和粘合剂的分解过程以及燃烧过程的最初阶段中,可以把金属颗粒当成惰性物质。根据气相反应所达到的温度高低,决定金属颗粒是否可以熔化,是否可以在该介质中进行点燃。此时,把金属颗粒当作惰性物质所对应的燃气温度,我们标记为T*,在研究金属颗粒燃烧特性时常常用到它。
对于固体推进剂的燃烧过程,除了提出气相型燃烧模型理论外有一种凝聚型燃烧模型理论。这个理论认为气相放热反应的气相区距离燃烧表面有一定距离,推进剂表面上凝缩相分解反应所需的热量一部分由气相反应供给,一部分由凝聚相放热反应供给,或者全部由凝聚相放热反应供给。这种理论提出的较晚,发展得还不完善,不过看来比较合理。
4.3.2金属燃烧特性概述
金属颗粒一般具有较高的点燃温度,总的说来金属组分比推进剂中其他组分燃烧得慢一些。在固体推进剂燃烧过程中,金属颗粒在燃烧表面上裸露并脱落,几乎独立地在气态火焰中移动并燃烧,在推进剂气相反应区下游很远的地方还在继续燃烧。通常可以认为金属颗粒不改变推进剂的基本燃烧过程,对于金属颗粒的燃烧可以单独地进行研究。
通过实验可以观察到,由于各种金属和其氧化物的特性不同,使得各种金属颗粒的燃烧情况是不同的,例如:
(1) 金属同其金属氧化物的挥发性不同(沸点情况不同),使得不同金属的颗粒在燃烧时的情况便不相同。
对于大多数金属(如Mg、Al、Be、Zr等)比其氧化物更易于挥发;但也有的金属(如B)比其氧化物更难于挥发。由于金属与其氧化物相对挥发性不同,而引起金属燃烧过程的性质也不同。例如对于硼这类物质燃烧时,在金属表面附近可能存在一个气态氧化物为主要组分的纯气态区。这种金属的燃烧机理也许同碳颗粒的燃烧机理相似,氧通过气态产物扩散到表面并在该处发生表面反应。金属燃烧与碳的燃烧也有显著不同之处:气态的金属氧化物气态离开燃烧的金属颗粒进入较冷的区域时,便开始凝结成氧化物的小颗粒。若金属比其氧化物更易于挥发,那么上述燃烧过程的情况便不会出现,因为此时根本没有纯气氧化物层围绕着金属颗粒的表面。
(2) 金属和其氧化物的互溶性不同(熔点不同),使得金属颗粒的燃烧情况和性质也不相同。
例如像Mg、Al、Be这类金属,它们和其氧化物是互不相溶的。这种金属颗粒在点火、燃烧过程中,金属颗粒表面上将形成一种在某些情况下会阻止点火和燃烧的氧化物保护膜。当颗粒表面温度低于氧化物的熔点时,金属和周围气体中的氧气很难接触,因此金属的点燃就难于发生,即使点燃后也难于使燃烧持续进行。
对于铝颗粒的单项实验表明,在大气压力下,如果要使铝颗粒发生点燃,气流温度必须超过铝的氧化物的熔点(≈2300K)。当氧的浓度增大时点燃温度可稍稍下降。在能够发生点燃的情况下,点火延迟时间与颗粒直径的平方成正比(对于直径为33m的颗粒,点火延迟时间为4μs)。随着燃气介质中含氧百分比不同,会发生不同的燃烧过程,作为初步近似,可以提出两种机理:(a)当氧的浓度大时,在燃烧过程中,围绕铝颗粒周围的那层氧化铝薄膜将发生爆裂;(b)当氧浓度小时,氧化铝薄膜不发生爆裂,燃烧发生在铝空心球表面的汽化相中,而燃烧时间与铝颗粒直径的1.8次方成正比,这证明了扩散现象的重要性。
对于铍颗粒的燃烧与铝的燃烧是相似的。为了点燃,必须使燃气介质的温度超过氧化铍熔点的温度(≈2800K)。
有人对铝颗粒的燃烧提出了一个简化的形象化图画。认为铝颗粒从开始加温到燃烬大致经历三个阶段,其燃烧情况如图4—2所示。
图4—2 铝颗粒的燃烧模型
第一阶段:金属颗粒加温到铝的熔点温度。这时形成了一个小的球形液滴,四周有一层氧化物的薄壳。
第二阶段:颗粒温度继续升高,达到点燃温度,进而达到维持燃烧的温度。在这一阶段末,颗粒表面温度超过氧化物的熔点,颗粒被一层液体氧化物薄膜所包裹。在金属蒸汽压作用下,这个液体氧化物薄膜被“吹起”,形成像肥皂泡似的泡沫,围在熔化金属液滴的四周。
第三阶段:金属蒸汽经过液态的氧化膜向四周扩散,周围介质中的氧向金属泡内相互扩散,使得金属铝和氧之间发生反应,完成燃烧反应。在此过程中金属液滴的尺寸不断减小。某些研究者指出,在此阶段中,随着金属液滴的漂移,氧化物薄膜常常爆裂,爆裂时出现明亮的闪光。随着金属颗粒的燃烧,围绕着颗粒的火焰温度高于燃气介质的温度。然后在流动过程中氧化物逐渐冷却。
对于另外一类像Ti和Zr这类金属,其金属和金属氧化物的熔液是完全可以混合的、互熔的。因此在金属表面上所形成的氧化物能比较快地进入内部,从而留下更多的裸露的金属。这些裸露的金属与气态氧化剂进一步发生碰撞,以可观的速率维持持续的表面燃烧。
总的说来,金属颗粒的燃烧是一个复杂的物理化学过程,对它的机理并没有了解得很清楚,上面所述仅是金属燃烧性态的极粗略的叙述,但对研究贫氧推进剂中金属颗粒的燃烧是有用的。
4.3.3燃气发生器燃烧室中金属颗粒的燃烧
推进剂中金属含量增加以后,虽然不能改变金属燃烧过程的基本特性,但要引起周围介质条件的变化,进而影响金属颗粒的点火、燃烧和火焰的传播。
金属的特点是着火点高,即使象Mg那样易燃的金属,其燃点也达到650℃,因而它们不可能参与第一区的燃烧,而是受分解和燃烧气体的影响,被加热和卷走,当条件不恰当时,金属有可能在界面上熔解并凝聚结块。这是在配方设计上应当注意的一个重要问题。
一般,含金属推进剂的燃速与不含金属推进剂的燃速差不多,金属组分倾向于在燃烧剂和氧化剂反应的热气态产物中以微粒形式参与燃烧。
对于火箭冲压发动机,并不要求所有金属燃料都在燃气发生器中燃烧。燃气发生器燃烧室中,除第一区外的空间属于第二区。在第二区中部分易燃金属燃烧,气态反应物进一步的应,并加热大量未着火金属微粒,此时,温度极其不均匀,已燃烧金属的小邻区内,温度很高,而被加热的未着火微粒的温度低于气态介质平均温度。
我们已经知道,燃气发生器的基本功能是以射流形式向混燃室供给燃料,使它同空气在混燃室中充分混合而获得完全燃烧。发生器供给的燃料包含有细散的金属颗粒和一些不完全燃烧产物。因为贫氧药中具有高金属含量和低氧含量,这就决定了金属颗粒的燃烧大部分是在出了燃气发生器以后,在高紊流度的射流边界层和空气中的氧接触时才进行。但是对燃气发生器中的一次燃烧过程仍然提出了严格的要求,例如要求金属颗粒能被迅速预热(使它进入着火延迟期,完成燃烧的准备);要求燃气发生器排出的射流具有一定的高温,并使金属颗粒的烧结减少到最低限度。
推进剂中金属含量提高以后,使金属烧结的倾向有所增加。所谓烧结现象,就是在金属颗粒周围介质温度较低的条件下,熔化了的金属颗粒相互结合在一起,使金属颗粒不断长大,甚至结成块。在组合发动机中,金属颗粒的烧结的现象严重影响发动机的工作,因为最终评价贫氧推进剂的燃烧性能,要看在整个燃烧过程中实际释放给工质的能量,即理论燃烧热值和燃烧效率的乘积。如果金属颗粒发生激烈的烧结现象,将引起燃烧效率强烈地下降。因此对于烧结现象,应予特别重视。要研究烧结的形成过程,影响烧结的因素以及消除烧结现象的措施。
如果在高温燃烧产物的作用下,金属能够很快的点燃,烧结就能降低到最小程度。因为在周围气体温度足够高的条件下,金属点燃的速度将快于烧结的发生。点燃过程和烧结过程的这种竞赛关系,与燃烧区的状态、向燃烧表面传递热量的速度以及组元颗粒尺寸等因素有关。如果火焰前峰离装药燃烧表面很近,此处温度梯度就很大,那么高速传递热量的结果将使金属颗粒在发生烧结以前就能很快地点燃。装药具有大的燃速(可选择高的燃烧室压力,或使推进剂具有小的氧化剂颗粒,或选择双基型粘合剂,或采用燃速催化剂等方法促使燃速增大),燃烧产物离开燃烧表面的速度加大,可以减少烧结的发生。当燃烧速度不大的条件下,相应地燃烧产物离开燃烧表面的流速就低,金属颗粒移动的速度也就很小,这就增加了金属颗粒烧结的可能性。长大了的颗粒,移动更加困难,就使烧结的倾向更进一步加大。
在氧化剂含量一定条件下,若氧化剂颗粒尺寸减小,能使氧化剂各晶体微粒之间的距离减小,能加快点燃,减少烧结。在金属含量一定的条件下,提高金属颗粒颗粒的密度,可使装药中金属颗粒的分布密度较小,能够促使金属颗粒的点燃,以减少烧结的发生。(锆的密度较大,为6440kg/m3,并且点燃温度低)。在一定努赛尔数(\(\text{Nu=}\frac{\text{ }\!\!\alpha\!\!\text{ d}}{\text{ }\!\!\lambda\!\!\text{ }}\))条件下,随着金属颗粒尺寸的减小,传热系数增大,使传热速度加快,使金属颗粒点火更加容易。
温度T*的高低,直接影响金属颗粒的点燃。高能粘合剂合高能氧化剂不仅能够提高推进剂的能量特性而且它能改善金属颗粒的传热和点火条件,以减少烧结现象。我们应该指出,贫氧推进剂的T*值随着贫氧程度的加大(与此同时金属含量增加)而下降。为了保证金属颗粒达到点燃的温度水平,预先应该有部分金属参加。实验证明,在贫氧推进剂中加入少量的镁可以得到比较好的结果(对于点燃来说),例如,对于含有45%高氯酸铵,30%铝,10%镁,15%粘合剂,如果镁和粘合剂一样同氧化剂反应,此时T*将升到2000K,有效地改善了铝颗粒的点燃条件。
对于像Al、Be这类与其氧化物不互溶的金属来说,在与氧化组分接触前就已加热到超过它们的点燃温度,这时在颗粒表面上就可以不存在氧化膜。为了造成这样的条件,可以由高熔点的物质进行包覆,直到基本金属没有加热到高于它的点燃温度之前,使基体金属与氧气隔开。现在在实验室中已由在铝的颗粒表面镀铬来改善点火性能的资料,例如可让铝颗粒在重铬酸钾溶液总形成镀层。另外一种类型的包覆层是容易点燃和能很快燃烧的物质,镁就是其中一种。包覆有镁层的颗粒可以从镁层的燃烧区更多地取得热量,使其下层的基体金属较快地加热到点燃温度,这个过程持续到镁层完全烧完为止,就不至于使基体金属颗粒表面形成很厚的氧化膜,以达到改善金属颗粒点火性能的目的。在水蒸气含量比较明显的气体中,发现一个意想不到的效果,在这种条件下,铍的点燃温度将减低或接近它的熔点温度。此时保护膜已经不是主要由氧化物,而是主要由氢氧化物或氧化物和氢化物的混合物组成,从而大大地降低了经过膜传递质量和热量的阻力。
由于硼具有高的热值和密度,在贫氧推进剂中大量添加硼颗粒正是有效提高容积比冲的最好途径。但是能否达到所期望的效果,还要看燃烧过程组织得怎样。硼的熔点很高(2500K),但其氧化物的熔点较低(B2O3熔点为723K)。一般在贫氧富燃的条件下,硼颗粒氧化缓慢,一般在燃气发生器中烧结现象很少发生。在燃气发生器中硼颗粒一般并不能被点燃,只能使颗粒预热,常常在颗粒加热期未结束以前,颗粒就已经进入混燃室了。在高温贫氧的条件下,硼颗粒表面没有氧化,往往和碳颗粒混在一起,形成碳化物的残渣进入混燃室了。实验证明,提高燃气发生器中的燃烧温度,使硼颗粒充分预热,燃烧效率(补燃过程)将得到提高。例如燃气发生器的燃烧温度由750K增至2000K,燃烧效率由0.85提高到0.94。因此采用高能粘合剂和氧化剂,使硼颗粒在燃气发生器中充分预热,是改善硼颗粒点火条件由实际意义的措施。许多作者,常常从完全燃烧的角度出发,用燃气发生器燃烧产物和空气的混合物计算出来的介质温度T*,来决定硼含量的上限。要使硼颗粒在混燃室中能很好的点火和燃烧,要求硼颗粒的尺寸要尽量小些。如果燃烧过程组织得不好,硼颗粒来不及燃烧就可能被排出发动机,造成能量损失。
在贫氧条件下组织一次燃烧是一件困难的事,容易出现金属烧结、碳化物结渣、燃速过低达不到要求、凝聚相熔融物在喷管壁上沉积、喷出效率不高及金属预热不够等问题。
为了改善一次燃烧,已进行了许多研究工作。在配方设计中,必须考虑一次燃烧的组织特点,尽可能为每一燃烧区创造较好的环境条件,充分发挥推进剂各组元的“合作效应”。下列研究结果可以供配方设计参考。
1) 为了使固气燃烧界面附近燃烧组织好,可以把金属看作惰性物质,推进剂中其余物质应有恰当配比。使火焰峰离药柱近,并有较高温度。同时气体生成量要大一些。这样有利于金属卷离界面,使着火倾向超过烧结倾向。
2) 提高燃速是克服金属、碳化物烧结倾向的好办法。必要时,可以同时采用化学增速和物理增速措施。
3) 添加少量镁粉、镁锂合金粉,可以提高一次燃烧火焰温度、增加活性氧、提供高温微热源,有明显的改善一次燃烧的效果。
4) 适当的金属粒度级配,有利于改善微粒的分布,减少金属烧结倾向。
5) 试验表明,用部分钾盐(如硝酸钾、氯酸钾、高氯酸钾)替代高氯酸铵作氧化剂,可以有效降低一次燃烧的残渣,并改善二次燃烧性能。
6) 由于硼和氟反应强烈,加入少量氟氧化剂,可以改善硼的着火性能。
7) 研究表明,采用碳化型绝热材料作燃气发生器喷管喉衬材料,可减少喷管喉部沉积现象。
喷管动力过程使气态反应物被大大加速,而微粒也被加速,形成明显的速度差。微粒间的碰撞增加了,喷管的直径一般相当小(特别在多喷管时),熔融态金属微粒和碳渣有在喷管壁上沉积的倾向。
一次燃烧过程为二次燃烧(空气补燃)过程创造了良好的准备条件。一次燃烧产物中含大量H2,原子态O,中间态活性反应物,已加热的金属微粒和高温氧化物。中能贫氧推进剂的试验研究表明:燃气发生器燃气特征燃烧速度Cg*,接近于平衡热力计算理论值。
不同金属的着火和燃烧性能往往存在很大的差异,这是由于金属—金属氧化物系统的特性不同引起的。这个问题对火箭冲压发动机十分重要。
4.3.4 含硼贫氧推进剂燃烧
与常规固体火箭推进剂相比,贫氧推进剂由于氧化剂含量低和一次燃烧不充分。这种推进剂燃烧时燃面上有大量的固体粒子喷射,产生大量黑烟。由热力计算知:含硼贫氧推进剂(其中硼为30%;镁铝为5%;AP为35%;HTPB粘合剂体系为30%)的凝聚相燃烧产物主要是没有参与反应的硼(约占推进剂中总硼量的88%),硼的氧化物(B2O3、B4C等),MgO,C,H2O等,其凝聚相产物的含量占推进剂总质量的80%以上。贫氧推进剂的组成特点及其使用环境决定了它的燃烧与常规火箭推进剂不同。在其燃烧性能的研制过程中,经常会出现一些非正常燃烧,可归纳如下:
- 燃烧的不稳定性。由于贫氧推进剂中氧化剂含量大大降低,因此在氧化剂颗粒的上方以及氧化剂周围,分解速度或燃烧速度都比远离氧化剂颗粒的粘合剂部分燃速高,这是造成贫氧推进剂燃烧不稳定的原因之一;另外由于金属含量增加,金属颗粒燃烧时的溅射作用也造成推进剂燃烧的不稳定。在测定贫氧推进剂燃速时,经常发现推进剂呈现出层状燃烧、燃烧过程中推进剂成块脱落等现象。法国的Fourest等人还观察到在低压下贫氧推进剂燃面上固体残渣周期性飞离燃面的不稳定燃烧现象。
- 含硼贫氧推进剂燃烧缓慢。一方面,由于贫氧推进剂中氧化剂含量少,推进剂燃烧的不完全程度增加,燃烧放热量低,因此贫氧推进剂燃速低;另一方面,由于非壅塞燃气发生器的工作环境,贫氧推进剂的工作压强一般在0Mpa以下,如此低的工作压强不仅贫氧推进剂的燃速低,而且对其燃烧稳定性也是一个严峻的考验。
- 含硼贫氧推进剂点火困难。贫氧推进剂中氧化剂含量低,其点火比常规固体火箭推进剂点火需施加的能量和热量更大,而且其点火延迟时间也长。
- 含硼贫氧推进剂燃烧不完全。高能的含硼贫氧推进剂中氧化剂含量少,燃烧温度低,低压燃烧时有浓浓的黑烟,凝聚相产物较多,使燃烧不完全的程度增加。
含硼贫氧固体推进剂是由氧化剂、有机粘合剂、硼粉、镁粉或镁铝合金及其它附加组分构成的非均相混合物。其燃烧过程与复合固体推进剂相似,是由一组同时发生在气相、液相和固相的化学反应以及扩散、传热等物理过程所构成的一种相当复杂的物理-化学过程。整个燃烧过程不同程度地受火焰区的气相反应、燃烧表面及亚表面的凝聚相反应所控制。而燃烧研究工作的目的是研究固体推进剂各组分在推进剂燃烧过程中的能量释放过程和释放规律,并利用这些规律,采用合适的手段来控制和改善推进剂的燃烧过程,使之满足发动机的性能要求。
固体推进剂在燃烧过程中,凝聚相受热转变为气相,一方面是通过物理蒸发和升华,但更主要的形式是组成推进剂的各组分在燃烧表面通过热分解反应变成气态产物。因此一般认为,热分解是推进剂燃烧过程的最初阶段。然后分解的气态产物再进一步发生燃烧反应。通常把固体推进剂的燃烧分为凝聚相反应和气相反应两大区域。凝聚相反应主要由推进剂中氧化剂、粘合剂的热分解反应及两者分解产物之间的反应构成,凝聚相反应的产物或凝聚相气化产生的物质进入气相后进一步进行燃烧反应。Schmiidt WG和Kiehore等人就是认为推进剂各组分首先发生一系列分解,产生可进一步燃烧的气态产物,并认为推进剂实际燃烧反应虽然发生在气相,但由于气相反应较凝聚相反应要快的多,因此从化学动力学的角度出发,得出了凝聚相反应是推进剂燃烧过程主要控制步骤的推论,从而说明凝聚相反应在推进剂燃烧过程中的重要性。由于热分析试验可以模拟推进剂的凝聚相反应过程,故热分析方法被广泛用于固体推进剂的燃烧性能研究。
(1) 含硼贫氧固体推进剂的主要组分热特性
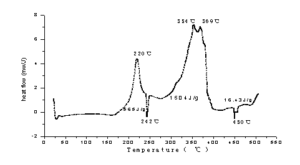
无定形硼在空气中和氮气中的热分解实验表明,220℃时,样品开始增重;480℃~640℃之间,样品快速增重并伴随放热反应。硼粒子的增重百分比与粒子直径成反比。800℃以下,硼的氧化产物主要以B2O3的形式存在,BN存在的几率极小,这为计算确定硼的反应量提供了依据。
HTPB,粘合剂。低温放热峰的起始温度为202℃,峰值温度为230℃;高温放热峰的起始温度为325℃。热失重的起始温度为421.7℃,494.64℃失重结束。423.8℃和470.6℃时,失重速率最大。
AP,氧化剂。在300℃以下,为低温分解阶段。分解到30%以后停止。剩余物仍为高氯酸铵,其化学性能无变化;在350℃~450℃之间,为高温分解阶段;在450℃以上,热分解进行的非常迅速,分解气体压力突然升高,甚至发生爆炸。应该注意,在低温和高温分解期间均伴随高氯酸铵的离解和升华。AP分解反应放热为1440.3J/g。
1:1的AP与硼不同接触方式的热分解实验表明:硼在AP分解过程中参与反应并放热,且氧化产物主要是B2O3;因热动力学揭示HCl对硼的氯化物来说是一种优选产物。硼在AP分解过程中的反应首先是AP分解产生氧化性的气体(AP分解的中间产物和最终产物),然后氧化性气体再扩散到硼粒子表面与硼发生氧化放热反应,故硼的存在影响了AP分解的TGA曲线的低、高温分解的峰值温度和DSC曲线的放热量。 AP粒度的减小使同比例混合物的AP与硼的接触面积增大,A P包覆在硼表面使其接触面积最大,随AP与硼接触面积的增大,单位质量AP/B(1:1)混合物热分解的放热量增加,混合物低、高温最大分解速率温度降低,表明放热反应更容易了。
对两种KP/硼混合物的热分析结果进行分析,表明,硼的存在加速了KP的分解,使KP的分解速率最大点的温度降低了67℃;在KP分解过程中,钾盐的存在改善了硼的反应活性,硼与KP及KP的分解产物发生氧化还原反应,同时大量放热;与硼在AP分解中的反应放热相比,反应活性大为增加;AP包覆硼削弱了硼在KP分解过程中的反应活性。
(2) 含硼贫氧固体推进剂低压燃烧机理【33】
1) 含硼贫氧推进剂的热分解
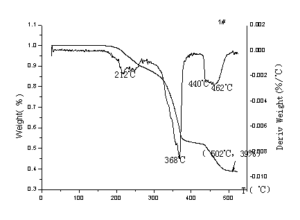
由推进剂的TGA和DSC曲线(图4-3、图4-4)可以看出,含硼贫氧推进剂的热分解主要集中在以下三个温区:
第一温区为168~276℃。从TGA曲线可知,约168℃时,失重开始,同时失重速率增加,到212℃为失重速率最大点,其后减速失重到276℃失重渐趋恒定。在DSC曲线上,从168℃开始放热,到276℃放热终止,放热峰为220℃,在242℃附近的吸热峰为AP晶转吸热。失重主要是AP的低温分解,伴随工艺助剂的挥发过程;放热主要是AP分解产生的氧化性产物或中间产物与镁铝合金或硼之间的作用,AP自身低温分解放热很弱。
图4-3 含硼贫氧推进剂的TG-DTG曲线
图4-4 含硼贫氧推进剂的DSC曲线
第二温区为276~410℃。TGA曲线从276℃到310℃缓慢失重,310℃到380℃快速失重, 370℃为失重速率最大点,380℃到410℃失重速率突减。DSC曲线在整个第二温区有两个大的放热峰,峰值温度为分别在354℃和369℃附近;HTPB在250℃~410℃温度范围内发生解聚反应、环化反应和交联反应并分解放热[80];276~370℃为AP的主分解区,强烈放热,所以354℃的峰为AP分解放热峰。AP分解过程中产生的氧化性气体与它所接触到的镁、铝、硼或HTPB发生氧化还原反应,同时放出大量的热,一直到AP主分解区以外,这些反应仍在进行,于是在369℃又出现一峰温;硼的氧化反应滞后于MA的氧化,于是在380℃还出现一不很明显的峰。由于与Mg、AL、B反应生成的MgO、AL2O3、B2O3等是凝聚相,所以约在380℃以后,失重减弱。三种放热方式在整个温区无法截然分开,存在相互叠加的状况。
第三温区,410℃以上。与AP/HTPB(1:1)混和物的热失重曲线一致, 410℃~520℃之间的失重是HTPB降解过程,HTPB降解放热很微弱。在450℃左右的吸热峰为镁铝合金的熔化峰。
为了提高含硼贫氧推进剂的性能,目前在改善硼的点火和燃烧性能的研究中,对硼进行包覆是一种比较好的方法。 对配方相同的两含硼贫氧推进剂的热分解特性、低压燃速和爆热进行比较,发现经AP包覆硼粉加入推进剂比硼粉直接加入推进剂燃速得以提高,凝聚相放热增加,爆热也提高,但气相放热有所减少。故凝聚相放热量大是含硼贫氧推进剂低压燃速高的主要原因,即对含硼贫氧推进剂,凝聚相反应是其低压燃烧的控制步骤【34】。
2) 燃烧波温度分布
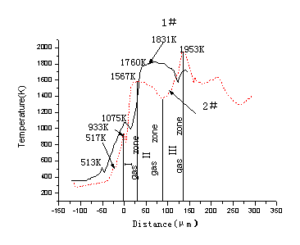
推进剂从凝聚相到气相区整个燃烧波的温度分布(T~t)可以直接测量得到。这种曲线不应把燃速的因素排除在外,因此需要通过变化得到T~x曲线,以比较两不同燃速的温度分布。采用的方法是在T~t曲线的时间轴上乘以该压力下推进剂的燃速,变换后得到T~x曲线,如图4-5所示。
由该推进剂的温度分布曲线可知,推进剂在约515K左右的转折点为AP的晶转温度,硼没有包覆的1#推进剂的燃面温度Ts为1075K,绝热火焰温度Tf为1831K。硼经AP包覆的2#推进剂的燃面温度Ts为933K,绝热火焰温度Tf为1953K。在固相燃烧表面附近温度基本是单调上升,该区域为产生化学反应区域,假设定义为凝聚相反应区。在1#推进剂中该凝聚相反应区的范围为从燃烧表面下约39μm处约518K的点到燃烧表面,在2#推进剂中该凝聚相反应区的范围为从燃烧表面下约20μm处约513K的点到燃烧表面。两推进剂凝聚相反应区的起点都与AP的分解温度大体一致。
在燃烧表面之上的气相反应区,温度-时间曲线较为复杂,估计是气相反应区反应复杂所致。但从趋势上讲,两推进剂气火焰相区还是比较相似的。
图4-5 燃烧波温度分布
根据含硼贫氧推进剂气相区温度变化的总趋势可以分为三个区。
在气Ⅰ区温度快速上升,达到T1,即在该阶段以放热反应为主,主要的反应为高氯酸铵分解产生的NH3、HCLO4和HTPB分解产生的气体产物及低燃点的镁铝合金在燃烧表面附近进行反应,大量放热,这也是气相区的主要放热。硼由于在凝聚相中的反应,表面包覆一层氧化物,氧化物(B2O3)的沸点在1900K以上,也就是硼的点火燃烧需满足1900K的高温氧化环境,故硼在该区的氧化放热占的份额很小。尤其对于2#推进剂,更多的硼在凝聚相参与反应,表面氧化层厚度相对1#推进剂中的硼更大,故在该区反应的几率更小。该区的划分,一方面是根据温度节点,另一方面,由于该种推进剂贫氧,在该区一个最大特点是AP分解产生的氧化性气体产物在该区基本已全部消耗。后面两区基本无强氧化性气体的存在。
在气Ⅱ区,温度下降,说明该阶段吸热反应占优势,分析硼的氧化过程,由于硼的沸点很高,所以硼与活性氧在300~2200K(含硼贫氧推进剂的一次燃烧温度一般低于2200K)的温度范围只发生异相反应。在600K时,硼在氧化性气氛中开始缓慢氧化,到750K时,硼粒子表面的氧化层B2O3由固态融化为液态,氧气通过氧化层扩散反应,温度小于1050K以下,硼的氧化产物以B2O3为主要形式,其主要反应为:
4B+3O2→2B2O3+Q1
在1050K~1500K时,硼的氧化产物以B2O2为主要形式,并含有少量的B2O3、BO和微量的BO2,其主要反应为:
2B2O3+2B→3B2O2+Q2
在1500~2200K时,硼的氧化产物以BO为主要形式,并含有少量的B2O2、B2O3和微量的BO2,其主要反应为:
B2O2→2BO+Q3
其中,Q1>0,为放热反应;Q2<0,Q3<0,为吸热反应。
即因为贫氧推进剂氧化剂不足,该区硼及其氧化物的反应吸热为主。
在气Ⅲ区,温度有所升高,达到Tf,说明该阶段放热反应稍占优势。因含硼贫氧推进剂中氧化剂的含量远小于化学计量比,随着气相区的推移,氧化性气体的消耗,气相区氧化性气体浓度越来越低,燃烧气体中碳氢气态产物在高温下碳化,产生的碳在高温度下会与硼发生反应,生成B4C,并放出少量的热。其反应为:
B+4C→B4C+Q4
因Q4>0,故最后又有温度升高的趋势。这里需要说明的是虽然热力计算表明有BN的存在,但凝聚相燃烧产物的X射线衍射分析过程中,曾对BN的存在做了假设,均不成立,即从衍射结果说明,BN不属燃烧产物。
实际上,气相中的三区划分只具有相对意义,对硼可能的反应同时分布在三区,只是各区的反应各有侧重。
- 骤冷中断燃烧的燃面特征
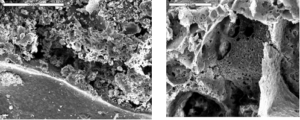
将推进剂切成样品紧贴在铜台上,然后放入透明窗燃烧室,在0.5MPa氮气压力下点燃试样,燃烧的推进剂由于传热损失而在铜台上熄灭,对局部或全部表面及某些特征点利用能谱仪进行元素分析,得到熄火表面的元素组成及分布。含硼贫氧推进剂的燃烧表面具有如下特点:
- 燃面上覆盖一层由大量裸露硼粒子、结碳和少量B2O3组成的珊瑚状疏松型惰性“沉积层”。
- 珊瑚状“沉积层”比较疏松,可以随燃气吹除或随燃烧的进行有规律地脱离燃面。
- 低压下,燃面存在粘合剂流动的痕迹,AP晶粒凸出在粘合剂表面之上;
- 凝聚相反应主要集中在靠近燃烧表面的亚表面层,该层中的放热为氧化剂蒸发和粘合剂热解提供能量。使推进剂温度升高到Ts,推进剂进入气相燃烧。压强的改变会影响亚表面层的异相反应,故该层的放热量与压力有关。
图4-6 中断燃面放大250倍的剖面 图4-7 剖切面图中靠上面一些的珊瑚状物的细微结构
4)含硼贫氧推进剂的燃烧特性总结
以多种测试手段为基础,对含硼贫氧推进剂的低压燃烧现象和机理进行了研究,得到了以下结论:
- AP包覆硼不仅改变了氧化剂AP与硼的接触面积,同时增加了AP与HTPB粘合剂间的接触面积,有助于氧化剂AP与硼、与粘合剂体系在凝聚相的反应,提高了凝聚相的放热;相应地,因氧化剂在凝聚相的消耗导致气相氧化性反应物浓度的降低,使气相放热减少。但总体体现为推进剂爆热增大,绝热火焰温度Tf升高。
- 通过比较含硼贫氧推进剂能量释放与低压燃速,认为:凝聚相放热量大是其低压燃速高的主要原因,即对含硼贫氧推进剂,凝聚相反应是其低压燃烧的控制步骤。
- 硼在凝聚相的氧化放热对燃速提高有贡献,气相区硼的反应只能发生在燃烧区的下游。
- 气相放热主要集中在气Ⅰ区。
- 含硼贫氧推进剂燃烧过程中燃面的推移决定于AP和粘合剂体系等可气化的组分,大部分的硼虽然没有参与燃烧,但它不能阻止燃面的推移。
- 含硼贫氧推进剂的燃面上覆盖一层由大量裸露硼粒子、结碳和少量B2O3组成“沉积层”。气相反应区与该 “沉积层”在空间上是重合的。
- 硼贫氧固体推进剂低压燃烧物理模型【35】
基于含硼贫氧推进剂低压燃烧的凝聚相反应和气相燃烧的特点,建立了含硼贫氧推进剂的低压燃烧模型,依据该模型解释该推进剂的特有燃烧现象。
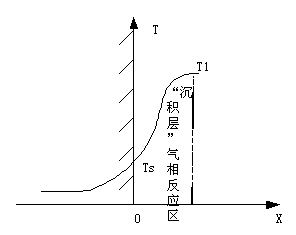
埋置热电偶进行温度分布测试及中断熄火推进剂纵向剖面得到含硼贫氧推进剂燃面上“沉积层”的存在,且该推进剂的气相反应在燃面上的惰性“沉积层”中进行。“沉积层”空隙中进行的是AP分解产物与HTPB分解产物间的扩散燃烧反应,因此仍能用BDP模型进行分析。
含硼贫氧推进剂的燃烧过程由两个区构成:凝聚相反应区和气相燃烧区。所有的凝聚相反应热都是在凝聚相反应区产生,并直接被推进剂吸收,而气相燃烧区中释放出的热量一部分通过对流和传导等方式反馈到燃面加热燃面附近的推进剂,另一部分用于燃烧产物自身的加热,使其温度急剧升高。假设燃烧表面位于x=0处,含硼贫氧推进剂的燃烧区可简化为凝聚相反应区和“沉积层”气相反应区,如图4-12所示。
在燃面以下的凝聚相反应区,硼粒子参与化学反应,并放热〔3〕。凝聚相反应包括粘合剂基体的解聚反应、AP分解产生的氧化性气体与粘合剂热解产物的反应、AP分解产物与硼的异相反应、AP分解产物与HTPB之间的异相反应等。
气Ⅰ区温度快速上升,达到T1,该阶段以放热反应为主,总体体现为放热,主要的反应为高氯酸铵分解产生的NH3、HCLO4和HTPB分解产生的气体产物在燃烧表面附近进行反应,大量放热,这也是气相区的主要放热。由于氧化剂AP颗粒具有一定的尺寸,所以,该区的气相扩散燃烧显然是三维的。在单个AP氧化剂晶粒周围的火焰由三个火焰构成。初焰(简称PF)它是AP分解产物与粘合剂热解产物间的化学反应火焰。它与扩散混合及化学反应速度都有关系,其反应式为:粘合剂热解产物(CH2、CH4、C…)十HCIO4分解产物+(CIO、OH、O2…)→燃烧产物,为一扩散火焰。高氯酸铵火焰(简称AP火焰)它是AP分解产物NH3和HCIO4之间的反应火焰,其反应式为:NH3(g)+HCIO4(g)→惰性产物十氧化性物质(30%O2),为一预混火焰。终焰(简称FF) 它是粘合剂热解产物与AP火焰的富氧燃烧产物之间的化学反应火焰。由于终焰的反应物均已预热(如富氧燃烧产物已被加热到AP火焰温度:1400K),故终焰速度仅决定于扩散混合速度。
图4-8. 含硼贫氧推进剂的温度分布
(3) 硼粒子的点火现象和机理【36】
早在六十年代,美国等西方国家就开始了硼粒子的点火、燃烧研究,并于七十年代初期提出了著名的King点火模型,此后在大量实验的基础上King又完善和发展了该模型。为了改善硼粒子点火,研究者提出了在硼粒子表面包覆一层易燃物质,这一技术有效地改善了硼粒子的点火;八十年代后期,借助高科技设备,研究者对硼粒子的点火、燃烧又有了新的认识,以Williams、K.K.Kuo为代表提出了新的硼粒子点火、燃烧模型。除美国外,俄罗斯、德国等国家也都在这方面投入了大量的人力物力。经过几十年的发展,人们已弄清楚了硼粒子的点火过程,提出了更完善的硼粒子点火模型,找到了改善硼粒子点火(降低点火温度,缩短点火时间)的方法和途径。
当硼粒子在空气中加热到1800~2000K时,它开始发光并持续一段时间,如果环境温度足够高,它便进入亮度更强、燃烧更猛烈的第二阶段。一般认为,硼粒子的燃烧过程由两个连续的阶段构成:第一阶段是硼粒子的加热以及它在液态氧化物层的包覆下与氧化性气体的反应,随着氧化层的蒸发和反应生成挥发性产物,氧化物层的越来越薄,当它完全挥发(厚度为零)时,第一阶段结束,这一阶段一般认为是点火过程;第二阶段是洁净的硼粒子(无液态氧化层)和周围氧化性气体之间的直接反应,生成最终燃烧产物或过渡性燃烧产物(它进一步氧化生成最终产物),这一阶段是燃烧过程,绝大部分硼是在这一阶段消耗的。
实验证明,在O2 +N2气流中,硼粒子点火温度高,点火时间长。直径为34.6μm的硼粒子,在2430K的O2+N2(氧气的摩尔分数为0.2)气流中,其点火时间为5.7ms,如此长的点火时间严重影响了硼粒子的燃烧效率。V.V.Golovko,M.J.Spalding等人分别研究了硼粒子在O2 +CL2和O2 +F2气流中的点火,他们发现在O2+F2气流中硼粒子的点火时间只有在O2+N2气流中点火时间的1/4,这是因为氟和硼反应生成的是气态化合物,因此在点火气流中加入含氟的化合物有利于加速硼粒子点火。
4.4 燃气发生器内弹道计算
燃气发生器的内弹道计算,从原则上说与一般的固体火箭发动机没有很大区别,因此一般固体火箭发动机的热力计算和内弹道计算方法都可以参考。对于这些内容本书不再重述。
值得提一下的是,因为贫氧药的燃烧过程由两个阶段组成,因此也需要有相应的两个阶段的热力计算,以提供燃气发生器和混燃室设计时所必需的数据。
在热力计算过程中,需要知道贫氧药及其燃烧产物的一系列物理化学性能数据。在缺乏这类数据的条件下,为了估算燃气发生器的燃烧温度等参数,在本章4.7节中介绍了一种简化的近似的估算方法作为读者参考。
4.5 壅塞式固体燃气发生器设计
固体燃气发生器是一个采用贫氧推进剂工作的固体火箭发动机,它的内弹道计算、药型设计等都与固体火箭发动机采用相同的方法。但是固体燃气发生器作为固体火箭——冲压组合发动机的一个部件,它不是一个独立的动力装置。为了使整个发动机达到良好的性能指标,要求燃气发生器能够很好地同进气道、混燃室等部件协同工作。因此在燃气发生器的设计方面带来了一些新的特点。
- 气发生器主要尺寸和燃烧室压力pr*的确定
对于一般固体火箭发动机,它作为一个完整的动力装置,设计的主要原始数据是总冲I(或者给出推力F和工作时间tr,总冲也就知道了,I=Ftr)。在总冲给定和推进剂选定以后,所需要的装药重量mpr,及其体积Vpr就被单值地确定了,因为
装药重量: \({{m}_{pr}}=\frac{I}{{{I}_{sr}}}\)
装药所占体积:\({{V}_{p}}=\frac{{{m}_{pr}}}{{{\rho }_{pr}}}\)
式中:Isr冲压阶段推进剂的比冲
ρpr推进剂的密度
此时,如果装药为侧面燃烧,装药长度也可以算出
\({{L}_{pr}}=\frac{{{V}_{pr}}}{\pi {{R}^{2}}-{{A}_{P}}}\)
式中:R火箭燃烧室内径;
AP燃烧室通气面积,如果装药为端面燃烧则AP=0。
考虑到燃烧室头部及尾部留有一定的空间,发动机燃烧室的长度就被确定了。因为燃烧产物是排到周围大气中的,和其它部件没有什么联系,所以在选定了燃烧室压力和尾喷管压力比后,尾喷管的面积比也就知道了。这样,发动机的主要尺寸都确定了。
燃气发生器设计的主要原始参数,在形式上与上述情况略有不同。首先给定的是燃气发生器的流量\({{\dot{m}}_{r}}\)工作时间tr。知道了\({{\dot{m}}_{r}}\)和tr以后,装药的重量\({{m}_{p}}={{\dot{m}}_{r}}{{t}_{r}}\)和装药体积\({{V}_{p}}=\frac{{{m}_{pr}}}{{{\rho }_{pr}}}\)也为之确定。接下去就可以确定燃气发生器的尺寸和燃烧室压力,这时除了遵循固体火箭发动机设计的一般方法外,还要考虑到同进气道和混燃室协调工作的问题。因为在固体火箭冲压发动机设计中,一般是先选定\(\overline{{{p}_{\text{r}}}}\)值(选\(\overline{{{p}_{\text{r}}}}\)>1.0,使燃气发生器喷管处于不完全膨胀工况),λ2值(一般选λ2=0.15~0.20),引射系数N,然后按下式计算燃气发生器的压力pr,以及fr值。
\({{p}_{r}}={{\bar{p}}_{r}}\bullet {{p}_{2}}={{\bar{p}}_{r}}\bullet {{\sigma }_{in}}p_{H}^{*}\pi \left( {{\lambda }_{2}} \right)\) (4-5)
\({{f}_{r}}=\frac{{{A}_{r}}}{{{A}_{2}}}=\frac{{{m}_{H}}}{{{m}_{r}}}\frac{1}{\alpha {{L}_{o}}}\sqrt{\frac{T_{r}^{*}}{T_{H}^{*}}}\frac{p_{H}^{*}}{p_{r}^{*}}\frac{{{\sigma }_{in}}}{{{\sigma }_{r}}}\frac{q\left( {{\lambda }_{2}} \right)}{q\left( {{\lambda }_{r}} \right)}\) (4-6)
由此可见,燃气发生器燃烧室压力pr*和喷管得面积比Ar/Art与进气道混燃室的设计是息息相关的。压力比\({{p}_{r}}/p_{r}^{*}\)的选定要留有裕度,要考虑组合发动机工作偏离设计点时,进气道不至于发生喘振、混燃室不至于出现临界工作状态,造成气流堵塞等。
在确定燃烧室压力pr*时,要考虑到pr*会影响正常燃烧。在发生器设计时,一定要使pr*大于推进剂能够正常燃烧的临界压力。对当前研制的贫氧推进剂来说,压力选择稍大一些对燃气发生器的正常点火和燃烧是有利的。此外,pr*要影响到推进剂的燃速,在设计时要适当考虑。
(2)装药设计
装药设计的主要任务是选择推进剂,确定装药几何形状和尺寸,进行强度校核。在确定推进剂几何尺寸时要满足以下要求:(a)流量\({{\dot{m}}_{r}}\);(b)工作时间;(c)燃烧室压力pr*;(d)燃烧室外径Dr。
推进剂选定后,特征速度C*,燃速系数a,压力指数n和推进剂密度ρpr都是已知的。在喷管临界面积确定后,应该保证在最低工作环境温度下(最低的推进剂初温),\[p_{r\min }^{*}>{{p}_{rcr}}\](推进剂的临界压力),流量能够满足\({{\dot{m}}_{r\min }}\)的要求,工作时间应满足\({{t}_{r\max }}\)的要求。在最高初温下,压力应满足总体提出的\[p_{r\max }^{*}\]的限制,流量和工作时间应满足总体提出的\({{\dot{m}}_{r\max }}\)和tr min的要求,因为:
\(P_{r}^{*}={{\left( C*{{\rho }_{pr}}a\frac{{{A}_{br}}}{{{A}_{tr}}} \right)}^{\frac{1}{1-n}}}\) (4-7)
式中:Abr为装药的燃烧面积;
Atr为燃气发生器喉部面积;
a为推进剂燃速系数,是一个与温度有关的参数;\(r=ap_{r}^{*n}\) (4-8)式中:r为推进剂燃速。
\({{\dot{m}}_{r}}=p_{r}^{*}{{A}_{tr}}/{{C}^{*}}\) (4-9)
\({{t}_{r}}=\frac{e}{r}=\frac{e}{ap_{r}^{*n}}\) (4-10)
式中e为推进剂的肉厚
燃气发生器的装药设计和一般固体火箭发动机的方法相同。根据具体情况可以采用侧面燃烧、端面燃烧或二者兼而有之。
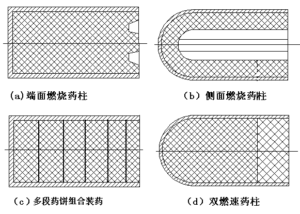
1、侧面燃烧:优点是发动机工作过程中导弹的重心变化小,并且对壳体热防护有好处。但是对弹径小,工作时间长的导弹,要求贫氧药柱具有很低的燃速值才能满足设计要求。例如若导弹弹径为335mm,工作时间为40s,采用侧面燃烧型式,燃速值就很低,大约为2~2.5 mm/s,如图4-9(b)所示。
2、端面燃烧:主要优点如下:
(1)可以使用燃速较高的贫氧药。一般贫氧推进剂含有较多的金属添加物,较高的燃速有助于减少金属颗粒烧结的倾向,以利于实现能量的有效转换。
(2)端面燃烧易满足时间长的要求
(3)端面燃烧的药柱形状简单。为了满足弹道上推力变化和冲压通道的协调工作,必要时可采用分段燃烧的药柱,即采用基本组分相似,但Hu、LO、ρP不同的几段药柱组合而成,如图4-9(d)所示。有时为了使贫氧药柱能够很好地燃烧,采用单独浇铸的药饼,间隔排列组合成药柱的方法如图4-9(c)所示。例如有人建议采用下面二种药饼间隔排列组成药柱:
一种药饼的组分为:硼粉(无定形) 45%
甲基奈 5%
另一种药饼组分为:NH4ClO4 40%
丁二烯一异丙烯吡啶 10%
端面燃烧的主要缺点是:壳体的热防护问题比较突出,同时由于燃气发生器接近于导弹的中部,端面燃烧会使导弹的重心变化增大。
图4-9 燃气发生器装药方案举例
对于侧面燃烧的装药来说,当然也可以采用组合式药柱,即采用二种不同的HU、LO、值的贫氧推进剂来组成,以满足加速和巡航的不同要求。图4-10中表示了这种组合式药柱的剖面图。
图4-10 侧燃双燃速装药
(3)影响燃气发生器工作的因素
燃气发生器对设计工况的偏离将会引起整个组合发动机工况的变化。一般来说,固体燃气发生器是不可调节的,因此分析以及控制影响燃气发生器工作的各种因素是很重要的。
常常把燃烧室压力pr*作为工作过程的代表性参数。因为pr*的变化,将使流量发生变化,从而使引射系数N、混燃室的燃烧产物成分,以及发动机比冲Isr等参数都发生变化。pr*改变了,使发动机的工作时间也发生变化。下面我们来分析影响pr*的各种因素。
由(4-7)式
\({{p}_{r}}*={{(\frac{C*{{\rho }_{pr}}a{{A}_{b}}}{{{A}_{rt}}})}^{\frac{1}{1-n}}}\) (4-11)
对上式取对数后微分,然后取差分,则得
\(\frac{\Delta {{p}_{r}}*}{{{p}_{r}}*}=\frac{1}{1-n}(\frac{\Delta C*}{C*}+\frac{\Delta {{\rho }_{pr}}}{{{\rho }_{pr}}}+\frac{\Delta a}{a}+\frac{\Delta {{A}_{b}}}{{{A}_{b}}}-\frac{\Delta {{A}_{rt}}}{{{A}_{rt}}})\) (4-12)
使燃气发生器工作偏离设计工况的因素,主要有三个方面:
1、发动机工作的环境条件不同,使推进剂的性能发生变化,从而使发生器工作发生变化。
固体贫氧推进剂的性能,特别是它的燃速特性随着环境温度(即推进剂初温)的变化而变化。对于一般推进剂来说,初温对燃速的影响都处理成对燃速系数a的影响。并且为了具体表示初温对燃速系数(也就是对燃速)的影响程度,引入一个新的参数σp,叫做燃速的温度敏感系数。
燃速的温度敏感系数是指压力不变,只有初温变化条件下,初温变化1℃所引起的燃速的相对变化量。用数学关系数表示就是:
\({{\sigma }_{P}}=\frac{{\Delta r}/{r}\;}{\Delta {{T}_{i}}}\) (4-13)
式中 Ti表示初温,△Ti表示初温的变化值(℃)
△r表示燃速的增量
\(\frac{\Delta r}{r}\)则表示燃速的相对变化量(%)
如果用微分形式来表示,则得
\({{\sigma }_{P}}=\frac{1}{r}\frac{dr}{d{{T}_{i}}}\) (4-14)
或 \({{\sigma }_{P}}=\frac{d\ln r}{d{{T}_{i}}}\) (4-15)
因为 \(r=a{{p}^{n}}\),当压力不变而只有初温度变化时(认为n=常数),则
\(\frac{d\ln r}{d{{T}_{i}}}=\frac{d\ln a}{d{{T}_{i}}}\)
因此 \({{\sigma }_{P}}=\frac{d\ln a}{d{{T}_{i}}}\) (4-16)
所以燃速的温度敏感系数也就是初温变化1℃时燃速系数的相对变化量。改写(4-13)式
\(\frac{\Delta r}{r}={{\sigma }_{P}}\Delta {{T}_{i}}\)
取 \(\Delta r={{r}_{{{T}_{2}}}}-{{r}_{T}}_{1}\)
\(\Delta {{T}_{i}}={{r}_{{{T}_{2}}}}-{{r}_{T}}_{1}\)
则同理可得:
\({{r}_{{{T}_{2}}}}={{r}_{{{T}_{1}}}}\left[ 1+{{\sigma }_{P}}({{T}_{2}}-{{T}_{1}}) \right]\) (4-17)
\({{a}_{{{T}_{2}}}}={{a}_{{{T}_{1}}}}\left[ 1+{{\sigma }_{P}}({{T}_{2}}-{{T}_{1}}) \right]\) (4-18)
从(4-17)和(4-18)中,可以明显地看出初温对燃速的影响。如果初温变化比较大,采用(4-17)或(4-18)估算初温对燃速的影响会带来较大误差。这时可以求解(4-14)式:
\(\frac{dr}{r}={{\sigma }_{P}}{{d}_{Ti}}\)
\(\ln r={{\sigma }_{P}}Ti+C\)
因此 \(\ln {{r}_{2}}-\ln {{r}_{1}}={{\sigma }_{P}}\left[ {{T}_{2}}-{{T}_{1}} \right]\)
同理可以得到:
\({{r}_{{{T}_{2}}}}={{r}_{T}}_{1}{{e}^{{{\sigma }_{P}}({{T}_{2}}-{{T}_{1}})}}\) (4-19)
\({{a}_{{{T}_{2}}}}={{a}_{T}}_{1}{{e}^{{{\sigma }_{P}}({{T}_{^{_{2}}}}-{{T}_{1}})}}\) (4-20)
(4-19)和(4-20)式是燃速或燃速系数随初温的一般关系。
贫氧推进剂的燃速温度敏感系数由实验获得。例如某推进剂在-40℃~+40℃范围内,其值为:
\({{\sigma }_{P}}=0.3%\) 1/℃
有了σp值,就可以计算初温度对燃速、燃烧室压力,燃气流量等参数的影响。例如在-40℃到+40℃温度变化范围内:
\(\frac{\Delta a}{a}=\frac{\Delta r}{r}={{\sigma }_{P}}\Delta Ti=0.3%(40+40)=24%\)
\(\frac{\Delta p_{r}^{*}}{p_{r}^{*}}=\frac{1}{1-n}\frac{\Delta a}{a}\) (式4-12式其它因素不计)
如 n=0.3,则
\(\frac{\Delta {{p}_{r}}*}{p_{r}^{*}}=\frac{1}{1-0.3}\cdot 24%=34.3%\)
因为由(4-9)式,当仅变化Pr*时,
\(\frac{\Delta {{{\dot{m}}}_{r}}}{{{{\dot{m}}}_{r}}}=\frac{\Delta {{p}_{r}}*}{{{p}_{r}}*}\)
所以 \(\frac{\Delta {{{\dot{m}}}_{r}}}{{{{\dot{m}}}_{r}}}=34.3%\)
由此可见,在上述条件下,发生器的流量及燃烧室压力都将变化三分之一左右。这是不可调固体燃气发生器工作性能的一个缺点。为了尽量减轻这个缺点的影响,在研制贫氧推进剂时应力求使σp和压力指数n都减小,这样可以减小燃烧室压力和燃气流量的波动。然而对于流量调节的燃气发生器n不能太小,一般为0.5~0.7左右。
2、发生器推进剂性能的偏差使发生器的工作产生变化。
贫氧推进剂制造工艺上的误差,使得各批产品的成分允许有一定的偏差,因此各批推进剂的性能,甚至同批推进剂的性能也允许有一定的变化范围,例如推进剂的特征速度C*、密度σp,燃速特性a和n等都在一定的允许范围内变化,致使pr*值也偏离设计值。一般\[C*=1000\tilde{\ }1200m/s\]
3、关键性的尺寸偏离设计值,使发生器的工作偏离设计值。例如装药燃烧面积Ab、喷喉截面直径Drt(面积Art)的变化,引起pr*的变化。特别应当注意喷管的烧蚀或金属颗粒沉积引起Art的变化。
装药初温引起燃气发生器工作的变化是很可观的。为了解决这个问题有人建议采用调节发生器喷管喉道面积Art的方法来进行调节。
因为\(p_{r}^{*}={{\left( \frac{C*{{\rho }_{pr}}a{{A}_{b}}}{{{A}_{rt}}} \right)}^{\frac{1}{1-n}}}\),为了保持pr*不变,Art应按照下面的变化规律进行调节。取20℃为“基准温度”则
\(\left. {{A}_{tr}} \right|{{\left. _{\text{Ti}}={{A}_{rt}} \right|}_{20}}{{e}^{{{\sigma }_{P}}(Ti-20)}}\)
如果为了保持发生器的燃气流量不变,在其他参数不变的情况下,Art应按下面的变化规律进行调节。
由(4-9)式可知,应当
\({{\left[ {{A}_{rt}}{{(\frac{a}{{{A}_{rt}}})}^{\frac{1}{1-n}}} \right]}_{20}}={{\left[ {{A}_{rt}}{{(\frac{a}{{{A}_{rt}}})}^{\frac{1}{1-n}}} \right]}_{T\text{i}}}\)
即 \(\left. {{A}_{tr}} \right|{{\left. _{\text{Ti}}={{A}_{rt}} \right|}_{20}}{{e}^{\frac{{{\sigma }_{P}}}{\text{n}}(Ti-20)}}\)
喷管调节问题,说起来容易,做起来(从结构上实现)就很困难。液体燃气发生器比较容易实现等压力或等流量的调节,这是液体燃气发生器的优点。
(4)燃气发生器的喷管设计
燃气发生器的喷管设计与整个组合发动机的喷管设计,无论在原则上或方法上都是一样的,可以参阅第六章的有关内容。这里仅讨论一下燃气发生器喷管的特殊性问题。
发生器喷管设计时会考虑到的一个新因素是与混燃室的设计有关的。有人提出,为了缩短混燃室的长度或者增大混燃室补燃效率,建议燃气发生器采用多喷管结构。为此我们对单喷管和多喷管两个方案做一些简略的分析,供设计时参考。
和单喷管比较,多喷管方案主要有下面一些优点:
1、在混燃室补燃效率相同的情况下,多喷管可以缩短混燃室的长度;或者在混燃室长度相同的条件下,采用多喷管可以提高燃烧效率。
从固体燃气发生器喷管排出的一次燃烧产物,是由可燃的和不可燃的气体组分,以及可燃的和不可燃的凝聚相物质所组成。有一种理论认为:如果不考虑一次燃烧产物中存在着慢燃的微粒,那么二次燃烧过程所需的时间主要取决于发生器排气射流与空气进行紊流扩散混合所需的时间。采用多喷管可以缩短紊流扩散混合所需的时间。
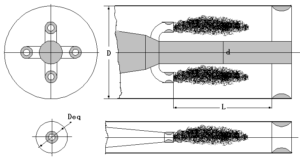
有人用气体燃料在单喷管和多喷管二种条件下进行了试验。为了试验结果进行比较,提出两个几何参数:混燃室的当量直径Deq和当量长度\({{\bar{L}}_{eq}}\)它们的定义如下:
\({{D}_{eq}}=\sqrt{\frac{{{D}^{2}}-{{d}^{2}}}{n}}\) (4-21)
式中 D,d——见图4-5所示
n——喷管的数目
采用单喷管时,混燃室的当量直径就是混燃室的内径。
当量长度\({{\bar{L}}_{eq}}\)为:
\({{\bar{L}}_{eq}}=\frac{L}{{{D}_{eq}}}=\frac{L}{D}\sqrt{\frac{n}{1-(\frac{d}{D})2}}\) (4-22)
图4-11 混燃室的当量直径和当量长度
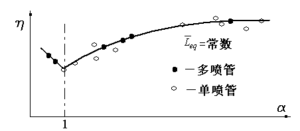
将燃烧试验的结果,按混燃室当量长度进行整理,如下图所示由图可见,当\({{\bar{L}}_{eq}}\)等于常数时,α大于某一定值以后,单喷管与多喷管能获得相同的补燃效率。
图4-12 补燃效率η与α及\({{\bar{L}}_{eq}}\)的关系
显然,对于多喷管来说,当\({{\bar{L}}_{eq}}\)相同,D相同的条件下,n越大则L越短。也就是说当补燃效率相同时,采用多喷管时混燃室的长度要短一些。
2、采用多喷管时,其喷管长度可以缩短,有利于缩短整个发动机的长度。
以锥形喷管为例,在相同的扩张角条件下,单喷管和多喷管长度之比为:
\(\frac{\ell }{{{\ell }’}}=\frac{{{d}_{rt}}}{{{{{d}’}}_{rt}}}=\sqrt{n}\)
式中,\(\ell \),drt 为单喷管的长度和喉径
\({\ell }’\),drt’ 为多喷管的长度和喉径
例如,n=4,则多喷管的长度仅是单喷管长度的一半。
多喷管方案与单喷管相比较,具有下面的一些主要缺点:
1、由于多喷管方案的喷管数目多了,使结构复杂了。
2、多喷管方案的每个喷管的喉径尺寸小了,金属颗粒在喷管壁面上沉积后,对喷管工作的影响增大了。例如为了保持发生器燃烧室的压力偏差相同,应该保持
\({{{d}’}_{rt}}=\frac{1}{\sqrt{n}}{{d}_{rt}}\)
\(\Delta {{{d}’}_{rt}}=\frac{1}{\sqrt{n}}\Delta {{d}_{rt}}\)
式中:\({{{d}’}_{rt}}\)、\(\Delta {{{d}’}_{rt}}\)为多管的喉径及其差偏量
\({{d}_{rt}}\)、\(\Delta {{d}_{rt}}\)为单喷管的喉径及其偏差量
根据同样的道理,多喷管喉径尺寸的精度要求也应当高些(喉径尺寸制造偏差引起的燃烧室压力偏差相同时)。例如单喷管dRl=20mm,选四级精度,公差为0.045mm。若采用四个小喷管时,则
\(\Delta {{{d}’}_{rt}}=\frac{1}{n}\Delta {{d}_{rt}}=\frac{1}{2}\cdot 0.045=0.023mm\)
\({{{d}’}_{rt}}=\frac{1}{\sqrt{n}}{{d}_{rt}}={{d}_{rt}}=\frac{1}{2}\cdot 20=10mm\)
这时多喷管喉径尺寸精度相当于二级精度。
3、多喷管更容易产生烧蚀
因为: \[\alpha {}_{c}=C\lambda P_{r}^{b}{{(\frac{4}{\pi \mu })}^{a}}\frac{\dot{m}_{r}^{a}}{{{d}^{1+a}}}\]
式中:\({{\alpha }_{c}}\)是对流换热系数, C,a,b是由实验确定的系数,如果取
\({{\alpha }_{c}}\)≈0.8
由上式可以得到:
\[{{{a}’}_{c}}={{n}^{0.1}}{{\alpha }_{c}}\]
可以看出,多喷管中每一个喷管的单位面积上的热流是单喷管的n0.1倍,因此多喷管受热严重,加之燃气对喷管壁面的摩擦应力大,热容量还可能小些,就容易产生烧蚀。
4、对于燃烧面较大,长细比也很大的发生器来说,多喷管的膨胀比受到发动机外径的限制比单喷管更严重些。
在喷管设计时,究竟选择多喷管还是单喷管,应视具体情况,全面衡量以后确定。
4.6 非壅塞式燃气发生器设计
采用非壅塞燃气发生器的固体火箭冲压发动机特点是燃气流量调节不采用常规的阀门控制机构,而是在导弹飞行状态改变时,直接利用富燃料固体推进剂特有的燃速特性自行调节燃气流量,从而保持相对稳定的空燃比,确保了固体火箭冲压发动机能够高效稳定的工作,其结构简单、可靠性高。非壅塞式燃气发生器设计重点解决推进剂燃速特性。
在内弹道方面,非壅塞式燃气发生器平衡压强按下式计算:
\(p_{r}^{*}={{\sigma }_{r}}{{P}_{3}}\)
式中: p3 ——补燃室前部压强(MPa),应由空气进气量、装药燃烧量和冲压喷管流出量的质量守恒方程求出。
σr——燃气发生器燃气流动总压修正系数;
pr*——燃气发生器的平衡压强,MPa。
燃气发生器中的燃气生成率\({{\dot{m}}_{r}}\)由下确定:
\({{\dot{m}}_{r}}=ap_{r}^{*n}{{\rho }_{P}}{{A}_{b}}\)
式中:a ——富燃料推进剂的燃速系数,m.s-1(MPa)-n;
n ——压强指数;
ρp ——推进剂密度,kg/m3 ;
Ab ——燃烧面积,m2。
当飞行状态变化使得进入冲压发动机的空气量减少时,p3将会降低,pr*也随之降低,从而导致燃气流量相应降低,反之则导致流量增加,实现对空燃比的自动调节,使空燃比保持相对稳定。
富燃料推进剂的压强指数越高,燃气流量的调节特性越好,当n=1.0时,非壅塞式固体火箭冲压发动机可以基本达到等空燃比调节。实际上当推进剂燃速压强指数大于0.5时,采用非壅塞方案已基本满足了导弹在飞行包线内空燃比较为合理、并且保证补燃室正常工作不熄火的要求。因此,用于非壅塞方案的富燃料推进剂,一方面要求其燃速压强指数尽可能高,另一方面要具有较低可燃压强极限,这也是非壅塞燃气发生器方案能否实现的关键。
影响推进剂低压可燃极限的因素有氧化剂含量及粒度、催化剂含量、金属粉种类及含量,实验证明:通过调节氧化剂粒度、添加燃速催化剂,是降低可燃极限的有效方法。
一般要求燃速压强指数大于0.5,由于富燃料推进剂中氧化剂含量少,金属添加剂含量多的组成特点决定了它的燃烧特性与常规推进剂有很大不同,一般富燃料推进剂的燃速和压强指数都比较低,要确保良好综合性能的前提下,大幅度提高燃速和压强指数是十分困难的,目前主要的解决途径有:选用合适的氧化剂类型和级配、高效燃速催化剂等,可以提高燃速; 选用合适的氧化剂及级配、提高配方固体含量和提高压强指数的燃速催化剂,可以达到提高压强指数的目的。
适当提高配方中氧化含量,增加推进剂热值,使药柱燃烧后成气性好,是一次喷射效率高的基本因素。试验证明通过采用调节金属含量配比、不同铝粉粒度、并添加高效燃速催化剂等方法,可以提高一次喷射效率。
4.7 贫氧推进剂热力计算的近似估算方法
燃气发生器热力计算的任务就是在给定推进剂成分、初温以及发生器燃烧室压力的条件,求出发生器燃烧室内燃烧产物的成分,温度和其它热力参数;在给定发生器喷管出口压力条件下,计算发生器喷管出口截面燃烧产物的成分,温度和其它热力参数。
大家知道,在燃气发生器的设计中,为了进行内弹道计算和传热计算,也需要知道燃烧产物的温度、成份及其有关的热力参数。因此,热力计算是燃气发生器设计的基本计算之一,它为燃气发生器的设计、混燃室的热力计算以及固体火箭—冲压组合发动机的设计提供了一些原始数据。
下面我们以表4-6中所列的推进剂配方为例,具体介绍近似估算方法的步骤。
表4-6中列出贫氧推进剂的主要成分,含量较少的组分没有考虑。
表4-6 贫氧推进剂配方及各组分参数
| 组元名称 | 化学式 | 重量百分比 | 燃烧热kJ/kg | 生成热kJ/kg | 分子量 | 密度kg/m3 |
| 有规丁竣
高氯酸铵 铝 镁 硼 |
CH1.518O0.051
NH4ClO4 Al Mg B |
12
40 10 3 35 |
41800
1400.3 31015.6 2470.3 58102 |
-1072.6
2469.5 0 0 0 |
14.35
117.5 27 24.3 10.8 |
920
1950 2700 1740 1740 |
(1) 推进剂的热值、理论空气量和密度
已知组分的重量百分比gi,热值Hui,理论空气量Loi和密度ρi,按下列公式计算推进剂的热值Hu、理论空气量Lo和密度ρi。
\({{\text{H}}_{\text{u}}}=\sum{{{H}_{ui}}}\text{ }{{\text{g}}_{\text{i}}} \)
\({{\text{L}}_{\text{o}}}=\sum{{{L}_{O}}}\text{ }{{\text{g}}_{\text{i}}} \)
\( \frac{1}{\rho }=\sum{\frac{1}{{{\rho }_{i}}}}\text{ }{{\text{g}}_{\text{i}}} \) (4-23)
1、推进剂的热值:
Hu=41800×0.12+1400.3×0.40+31015.6×0.1+2470.3×0.03+58102×0.35=29753(kJ/kg)
如果缺乏某组元热值的数据,可按下式进行计算:
\({{H}_{ui}}={{Q}_{c{{o}_{2}}}}+{{Q}_{{{H}_{2}}O}}+\cdots \cdots -{{Q}_{i}}\)生
式中:\({{Q}_{c{{o}_{2}}}}\),\({{Q}_{{{H}_{2}}O}}\)为一千克该组元中可燃元素(C,H2……)全部氧化的生成热, Qi生为一千克该组元的生成热。
2、推进剂的密度:
ρp=\(\frac{1}{\frac{0.12}{920}+\frac{0.4}{1950}+\frac{0.1}{2700}+\frac{0.03}{1740}+\frac{0.35}{1700}}\)=1678.6kg/m3
3、推进剂的理论空气量:
主要考虑下列反应
C+O2→CO2
H2+1/2O2→H2O
2Al+3/2O2→Al2O3
Mg+1/2O2→MgO
H2+Cl2→2HCl
2B+3/2O2→B2O3
一千克某物质(推进剂或组元)中各相应元素的重量百分数用符号〔C〕、〔H〕、〔B〕、〔Al〕、〔Mg〕……〔O〕等符号表示。
丁羧CH15.16O0.051中各元素的重量百分数为:
〔C〕=\(\frac{12}{14.35}\)=0.836
(因为在1摩尔丁羧中含有C元素12克)
〔H〕=\(\frac{1.516}{14.35}=0.106\)
〔O〕=\(\frac{16\times 0.051}{14.35}=0.0569\)
根据(4-4)式,可得
LO丁羧=11.5〔C〕+34.5〔H〕-4.31〔O〕=13.026
高氯酸铵 NH4ClO4中各元素的重量百分数为:
〔H〕=\(\frac{3}{117.5}\)=0.0255(扣除一个H原子,因为Cl也是氧化剂,H+Cl→HCl)
〔O〕=\(\frac{16\times 4}{117.5}\)=0.545
LO高氯酸铵=34.5〔H〕-4.31〔O〕=-1.469
铝Al:
LO铝=\(\frac{1}{0.232}\cdot \frac{8}{9}=3.831\)
镁Mg:
LO镁=\(\frac{1}{0.232}\cdot \frac{16}{24.3}=2.838\)
硼B:
LO硼=\(\frac{1}{0.232}\cdot \frac{3\times 16}{2\times 10.8}=9.575\)
推进剂的理论空气量
LO=13.026×0.12-1.469×0.40+3.831×0.1+2.838×0.03+9.575×0.35=4.794
(2) 推进剂的假定化学式
由质量守恒定律可知,在化学反应过程中,虽然物质分子的原子进行重新组合而生成新的分子,但各种元素的原子数目既不增加也不减少,即反应前后各元素的原子总数保持不变。因此贫氧推进剂经过燃烧以后,各元素的原子数应保持不变。也就是说,一千克贫氧推进剂中各元素的摩尔数应等于一千克燃烧产物中各相应元素的摩尔数。所以当我们知道了一千克推进剂的假定化学分子式之后,就等于知道了一千克燃烧产物中各相应元素的摩尔数,这给我们在分析燃烧产物的成分时提供了一个原始条件。
推进剂的假定化学式表示为
\({{C}_{NC}}{{H}_{NH}}{{O}_{NO}}{{N}_{NN}}C{{l}_{NC}}_{\ell }M{{g}_{NMg}}A{{l}_{NA\ell }}{{B}_{NB}}\)……
式中NC、NH、NO、NN、NCl、NMg、NAl、NB……是一千克推进剂中各相应元素C、H、O、N、Cl、Mg、Al、B……的原子数。
假定推进剂中含有n种组分。各组分在推进剂中的重量百分比用gi表示。一千克第i组分中含有元素C、H、O、N、Cl、Mg、Al、B……的摩尔数用Ci、Hi、Oi、Ni、Cli、Mgi、Ali、Bi……表示,因此
\({{N}_{C}}=\sum\limits_{i=1}^{n}{{{g}_{i}}{{C}_{i}}} \)
\( {{N}_{H}}=\sum\limits_{i=1}^{n}{{{g}_{i}}{{H}_{i}}} \)
\( {{N}_{O}}=\sum\limits_{i=1}^{n}{{{g}_{i}}{{O}_{i}}} \)
\( {{N}_{Al}}=\sum\limits_{i=1}^{n}{{{g}_{i}}A{{l}_{i}}} \)
(4-24)
例如一千克丁羧中含有各元素的原子数为:
Ci=\(\frac{1000}{14.35}\cdot 1=69.7\)
Hi=\(\frac{1000}{14.35}\cdot 1.516=105.67\)
Oi=\(\frac{1000}{14.35}\cdot 0.051=3.55\)
同理可以求出NH4ClO4、Al、Mg、B各组分中各元素的摩尔数。NC,NH……等值可以列表计算如下:
表4-7 推进剂假定化学式计算表
| Cigi | Higi | Oigi | Nigi | Cligi | Mgigi | Aligi | Bigi | |
| 丁羧
高氯酸铵 Mg Al B |
8.36 | 12.67
13.62 |
0.43
13.62 |
3.40 | 3.40 | 1.23 |
3.70 |
32.40 |
| ∑ | 8.36 | 26.29 | 14.05 | 3.40 | 3.40 | 1.23 | 3.70 | 32.40 |
因此,上述推进剂的化学假定式为:
C8.36H26.29O14.05N3.40Cl3.40Mg1.23Cl3.70B32.40
(3) 发生器燃烧室中燃气成份的估算
这里介绍的是燃气成份的一种估算办法,在对贫氧条件下燃气粗份不确切知道,以及缺乏必要数据的条件下,不妨参考采用。
因为发生器燃烧室中燃气温度一般小于2500K,为了简化计算,不考虑离解的组分。
本估算方法作了如下的一些假定:
1、推进剂中的氧元素首先满足Mg的氧化,然后是Al的氧化。但考虑到Al的含量很多时可能不能全部氧化。因此又规定在贫氧推进剂中Al的含量≤10%时,Al可以全部氧化为Al2O3;在贫氧条件下,当Al的含量≥15%时,则认为只有10%的Al氧化为Al2O3,其余的Al保留为液态。若采用铝镁合金时,则镁按比例氧化。
当gAl≤10%时 NAl*=NAl (4-25)
gAl>10%时 NAl*=\(\frac{1000\times 0.1}{27}\)
采用铝镁合金时:
NMg*=\(\frac{N_{Al}^{*}}{{{N}_{A\ell }}}\cdot {{N}_{Mg}}\) (4-26)
式中 NAl、NMg是一千克推进剂含有Al或Mg的摩尔数。
NAl*、NMg*是一千克推进剂中可以氧化的铝或镁的摩尔数。
2 Al+3/2O2→Al2O3
Mg+1/2O2→MgO
2、一千克推进剂中在Al与Mg氧化后剩余的氧元素的摩尔数用E表示。若E>0,则剩余的氧与碳化合生成CO;
C+1/2O2→CO
\(E={{N}_{O}}-\frac{3}{2}N{{_{A}^{*}}_{l}}-N{{_{M}^{*}}_{g}}\) (4-27)
氧化碳后剩余的氧元素的摩尔数用A表示。
A=E-NC (4-28)
若A>0,则剩余的氧参与水煤气反应,有H2O和CO2生成。
若E<0,表示碳元素不能全部氧化,则剩余的碳生成C3(气)。
3、因为B的点燃温度高,无剩余氧时,认为B全部在混燃室中与空气中的氧接触时才燃烧。
根据以上假定,当E>0 而A<0时,燃气成分由下列式子确定:
\({{n}_{MgO}}=N{{_{M}^{*}}_{g}}\)
\({{n}_{Mg}}={{N}_{Mg}}-N{{_{M}^{*}}_{g}}\)
\({{n}_{A{{\ell }_{2}}}}{{O}_{3}}=\frac{1}{2}N_{Al}^{*}\)
\({{n}_{A\ell }}={{N}_{Al}}-N_{Al}^{*} \)
\({{n}_{CO}}=E=No-1.5N_{Al}^{*}-N_{Mg}^{*} \)
\({{n}_{{{C}_{3}}}}=\frac{1}{3}({{N}_{C}}-{{n}_{CO}}) \)
\({{n}_{HCl}}={{N}_{Cl}} \)
\({{n}_{{{H}_{2}}}}=\frac{1}{2}({{N}_{H}}-{{N}_{Cl}}) \)
\({{n}_{B}}={{N}_{B}} \)
\({{n}_{{{N}_{2}}}}=\frac{1}{2}{{N}_{N}} \)
(4-29)
式中,n表示一千克燃气(混合气)中某种气体或凝聚相物质的摩尔数。
对于表4-6所列的贫氧推进剂:
E=14.05-1.5×3.70-1.23=7.27>0
A=7.27-8.36=-1.09<0
因此根据(4-29)式,它的一次燃烧产物的成分估算为:
\({{n}_{MgO}}=1.23\)
\({{n}_{A{{l}_{2}}{{O}_{3}}}}=\frac{1}{2}\cdot 3.70=1.85\)
\({{n}_{CO}}=E=7.27\)
\({{n}_{{{C}_{3}}}}=\frac{1}{3}(8.36-7.27)=0.36\)
\({{n}_{HC\ell }}=3.40\)
\({{n}_{{{H}_{2}}}}=\frac{1}{2}(26.29-3.40)=11.45\)
\({{n}_{B}}=32.40\)
\({{n}_{{{N}_{2}}}}=\frac{1}{2}\cdot 3.40=1.70\)
显然,这个估算方法有许多不合理的地方,估算出的成份在多大程度上反映实际情况,造成多大误差,有待实践检验。例如没有氧化的碳究竟怎样生成C3,还是以碳的固体颗粒存在,在\({{n}_{{{H}_{2}}}}\)的计算时没有考虑生成低分子碳氢化合物的情况;燃烧产物中忽略了相当多的其他燃烧产物等等,这些都是有待研究的问题。
(4) 贫氧推进剂的总焓计算
与一般固体火箭推进剂一样,贫氧推进剂的总焓按下列公式计算:
\({{I}_{T}}=\underset{i=1}{\overset{n}{\mathop{\Sigma }}}\,{{g}_{i}}{{I}_{i}}\) (4-30)
式中,IT一千克推进剂的总焓(kJ/kg)
Ii一千克第i组元的总焓(kJ/kg)
gi推进剂中第i组元的重量百分数
推进剂各组元在温度T时的总焓可以计算如下:
\[{{I}_{i}}=H_{fi}^{Ts}+\int_{Ts}^{T}{{{c}_{Pi}}dT}\] (4-31)
式中\(H_{fi}^{Ts}\)第i种组元在基准温度(常取Ts=298.16K)和基准压力(一个物理大气压)条件下的标准生成焓(kJ/kg)
当T=Ts时,则
\({{I}_{i}}=H_{fi}^{Ts}\) (4-32)
所以 \({{I}_{T}}=\underset{i=1}{\overset{n}{\mathop{\Sigma }}}\,{{g}_{i}}H_{fi}^{Ts}\) (4-33)
对于表4-6所列的贫氧推进剂:
\({{I}_{T}}=0.12\times 1072.6+0.40\times (-2469.5)\)
=\(-859.1\text{kJ/kg}\)
应该注意:标准生成焓与生成热,在数值上相等,但符号相反。
(5) 燃烧产物总焓的计算
贫氧推进剂的燃烧产物是由多种产物组成的混合物,其总焓等于各产物的总焓之和
\({{I}_{r}}=\underset{i=1}{\overset{m}{\mathop{\Sigma }}}\,{{n}_{i}}{{I}_{{{r}_{i}}}}\) (4-34)
式中:Ir——一千克燃烧产物(混合物)的总焓〔kJ/kg〕
Iri——一摩尔第i种燃烧产物的总焓〔kJ/mol〕
ni——一千克燃烧产物中第i种产物的摩尔数
在不同温度下,第i种燃烧产物的总焓可按下列公式计算:
\[{{I}_{ri}}=H_{fi}^{Ts}+\int_{Ts}^{T}{{{c}_{Pi}}dT}\] (4-35)
但是,不同温度下各种燃烧产物成分的总焓已计算出并制成表格,可以直接查用。
对于表4-6所列的贫氧推进剂,计算1800K和2000K时燃烧产物的总焓,列于下表内。
表4-8 燃烧产物的总焓计算表
| 燃 烧
产物名称 |
摩尔数
ni |
1800K | 2000K | |||||||||||||||||||||||||||||||||||||||||||
| Iri | niIri | Iri | niIri | |||||||||||||||||||||||||||||||||||||||||||
| Al2O3(液)
CO HCl C3(气) MgO(气) H2 B N2 |
1.85
7.27 3.40 0.36 1.23 11.45 32.40 1.70 |
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||
| ΣniIri | -1140.1 | -713.484 | ||||||||||||||||||||||||||||||||||||||||||||
(6) 贫氧推进剂的爆热反算燃烧温度
1、贫氧推进剂的爆热Qr,就是贫氧推进剂在燃气发生器中进行一次燃烧所放出的热量,由盖斯定律,可以得标准状况下的Qr:
\({{Q}_{r}}=\underset{i=1}{\overset{n}{\mathop{\Sigma }}}\,{{g}_{i}}H_{fi}^{298}-\underset{i=1}{\overset{m}{\mathop{\Sigma }}}\,{{n}_{i}}H_{fi}^{298}\)
对于表4-6所列的推进剂:
\(\underset{i=1}{\overset{n}{\mathop{\Sigma }}}\,{{g}_{i}}H_{fi}^{298}=-859.12\)kJ/kg
对于其燃烧产物的总焓,用与表4-8所用的方法,可以求得:
\(\underset{i=1}{\overset{m}{\mathop{\Sigma }}}\,{{n}_{i}}H_{fi}^{298}=-3895.46\)
因此
\({{Q}_{r}}=(-859.12)-(-3895.46)=3036.34\) kJ/kg
2、燃烧温度\(T_{r}^{*}\)
假设燃气发生器的燃烧过程是绝热的,根据能量守恒定律,推进剂的总焓应等于燃烧产物的总焓,即:
\({{I}_{T}}={{I}_{r}}\) (4-36)
根据这个关系,利用内插的方法可以求燃烧温度:
\(T_{r}^{*}=T_{{{r}_{1}}}^{*}+\frac{{{I}_{{{r}_{1}}}}-{{I}_{T}}}{{{I}_{{{r}_{1}}}}-{{I}_{{{r}_{2}}}}}(T_{{{r}_{2}}}^{*}-T_{{{r}_{1}}}^{*})\) (4-37)
在本例中:
\(T_{r}^{*}=1800+\frac{(-1140.1)-(-859.12)}{(-1140.1)-(-713.484)}\cdot (2000-1800)=1932\)K
(7) 燃烧产物的其它热力参数
1、一千克燃烧产物中气相和凝聚相的摩尔数及重量百分数。一千克燃烧产物中气相产物的摩尔数用ngi表示:
\({{n}_{gi}}={{n}_{CO}}+{{n}_{HC\ell }}+{{n}_{{{C}_{3}}}}+{{n}_{MgO}}+{{n}_{{{H}_{2}}}}+{{n}_{{{N}_{2}}}}\)
\(=7.27+3.40+0.36+1.23+11.45+1.70\)
\(=25.41\)
(按:在燃烧温度为1932K条件下,MgO能否以气态存在,是很成问题的)
一千克燃烧产物中凝聚相产物的摩尔数用nl表示:
\({{n}_{l}}={{n}_{A{{l}_{2}}{{O}_{3}}}}+{{n}_{B}}=1.85+32.40=34.25\)
凝聚相产物在整个燃烧产物中所占的重量百分数为:
\(\varepsilon =\frac{\Sigma {{n}_{li}}{{\mu }_{li}}}{1000}\)
式中nli、μli为第i种固相产物的摩尔数及分子量。
在本例中:
\(\varepsilon =\frac{1}{1000}(185\cdot 102+32.4\cdot 108)=53.86%\)
由此可见,在整个燃气产物中固相产物所占的重量是很可观的。含有凝聚相颗粒的流动称为二相流动,关于这方面问题在第六章中有一些阐述。
2、气相产物的平均分子量和平均气体常数气相产物的平均分子量\({{\mu }_{gi}}\):
\({{\mu }_{gi}}=\frac{1000(1-\varepsilon )}{{{n}_{gi}}}\)
气相产物的平均气体常数Rgi:
\({{R}_{gi}}=\frac{848}{{{\mu }_{gi}}}\)
本例中: \({{\mu }_{gi}}=\frac{1000(1-0.5386)}{25.41}=18.16\)
\({{R}_{gi}}=\frac{848}{18.16}=46.70\)kg.m/kg.K
3、整个燃烧产物(含有凝聚相)的平均气体常数
\({{R}_{r}}=(1-\varepsilon ){{R}_{gi}}\)
本例中:\({{R}_{r}}=(1-0.5386)\cdot 46.70=21.55\)kg.m/kg.K
4、燃烧产物的比热容容和比热容比
若整个燃烧产物由m种产物组成,某温度下整个燃烧产物的定压比热容容为:
\[{{c}_{Pr}}=\frac{\underset{i=1}{\overset{m}{\mathop{\Sigma }}}\,{{n}_{i}}{{c}_{Pi}}}{1000}\]〔kJ/kg.K〕
\[{{c}_{Vr}}={{c}_{Pr}}-{{R}_{r}}\]
式中:cPi的单位是kJ/mol.K
本例中,cPr的计算列于表4-9,得
\[{{c}_{Pr}}=\frac{2179.3}{1000}=2.18\]kJ/kg.K
\[{{c}_{Vr}}=2.18-\frac{21.55\times 4.18}{427}=1.97\]kJ/kg.K
因此比热容比kr为:
\[{{k}_{r}}=\frac{{{c}_{Pr}}}{{{c}_{Vr}}}=\frac{2.18}{1.97}=1.1\]
表4-9 燃烧产物定压比热容的计算
| 组分名称 | 摩尔数ni | 比热容cPi J/mol.K | nicPi |
| Al2O3
CO HCl C3 MgO H2 B N2 |
1.85
7.27 3.40 0.36 1.23 11.45 32.40 1.70 |
138.44
36.12 35.32 58.85 37.95 34.03 31.56 35.82 |
256.07
262.55 120.05 21.19 46.69 389.41 1022.51 60.90 |
| Σ | 59.66 | 2179.33 |
(8) 燃气发生器喷管出口参数的计算
在喷管流动过程中,燃气的温度和压力(沿着喷管长度)变化很快。随着燃气(多组分的)温度和压力的变化,由于解离产物的复合作用,燃气的成分可能发生变化。并且大家也知道,气体的比热容随着温度的变化也发生变化。因此喷管中的热力计算,与燃气在喷管内流动过程中燃气成份的情况以及比热容的情况有很大关系。因为燃气在喷管中流动速度很大,它在喷管中的停留时间很短,因此就存在一个问题:燃气的成份能否跟得上温度和压力的变化速度而始终保持为化学平衡成份?燃气的比热容是跟得上燃气温度的变化而始终与温度相适应?这些问题到现在为止还没有研究得很透彻,我们只能作某些简化假定,在这些假定条件下对喷管中流动过程进行热力气动计算。
为了使喷管的热力计算能够进行,对喷管中的流动过程作了如下设想:
1、平衡流动:认为燃气在喷管内流动过程中,燃烧产物的成份随着温度和压力的变化而变化,而且保持为该温度和压力条件下的化学平衡成份。燃烧产物的比热容不仅随温度而变化,而且随成份的变化而变化,始终保持为该温度该成份条件下的对应值。
2、成份和比热容全冻结的流动:“冻结”一词意谓着不变的意思。燃气的成份和比热容,尽管温度和压力在变化,它们保持不变。
3、成份冻结流动:燃气成份不随温度和压力变化,但比热容随温度而改变。
在实际情况下,一般说来喷管中燃气成份既不是化学平衡的,也不是冻结的,而是介乎二者之间,这种流体称为松弛流动。对于松弛流动虽然有一些研究成果,但是计算很复杂。
在实际工作中,究竟按那一种流动模型进行计算,视具体情况而定。
下面我们以成份和比热容全冻结的流动情况,接着前面所举的例子,进行喷管的热力计算:
若给定喷管出口截面压力为0.35MPa,燃烧室的压力为7MPa
即喷管出口截面的温度Tr为:
\[{{T}_{r}}=T_{r}^{*}{{(\frac{{{p}_{r}}}{p_{r}^{*}})}^{\frac{{{k}_{r}}-1}{{{k}_{r}}}}}\]
=\(1932{{(\frac{0.35}{7})}^{\frac{1.11-1}{1.11}}}=1435K\)
喷管出口截面的速度:
\({{V}_{r}}=\sqrt{\frac{2{{k}_{r}}}{{{k}_{r}}-1}{{R}_{r}}T_{r}^{*}\left[ 1-{{(\frac{{{p}_{r}}}{p_{r}^{*}})}^{\frac{{{k}_{r}}-1}{{{k}_{r}}}}} \right]}\)
=\(\sqrt{\frac{2\times 1.11}{1.11-1}\times 21.55\times 1932\times \left[ 1-{{(\frac{0.35}{7})}^{\frac{1.11-1}{1.11}}} \right]}\)
=1455米/秒
\({{\lambda }_{r}}=\frac{{{V}_{r}}}{\sqrt{{{k}_{r}}{{R}_{r}}g{{T}_{r}}}}=\frac{1455}{904}=1.61\)
理论特征速度C*
C*=\(\sqrt{\frac{g{{k}_{r}}T_{r}^{*}}{R}}\) R=kr\({{\left[ \frac{2}{{{k}_{r}}+1} \right]}^{\frac{{{k}_{r}}+1}{2({{k}_{r}}-1)}}}\)
C*=\(\sqrt{\frac{9.81\times 21.55\times 1932}{0.6204}}=1030\)(m/s)
以上介绍的仅仅是一种近似的计算方法,仅供参考。