第五章 化学火箭发动机推进剂性能分析
第三章已建立了简化的一维性能关系式。要利用这些关系式,需要知道发动机热燃气组分和推进剂反应产物的物性,如燃烧温度T1 、平均分子量M、比热比或焓变(h1-h2)。本章讨论一些在给定推进剂组分、燃烧室压力、喷管形状和喷管出口压力下确定这些热化学性质的理论方法。由此可以确定性能参数,如化学火箭发动机的理论比冲或排气速度。
通过计算得到气体温度、压力和气体成分(例如,是还原性还是氧化性成分)后, 就可以计算气体的其他性质。有了这些知识后,就可以作更深入的分析和灵活地选择燃烧室和喷管的结构材料。传热分析需要知道气体混合物的比热、导热系数和比热比,计算得到的排气成分是估算对环境的影响(如第二十章讨论的有毒气体在发射场附近可能的散布范围)的基础,此外排气参数还是排气羽流(第十八章)或喷管外火焰分析的基础。
由于数字计算机的发展,人们现可以求解涉及质量平衡、能量平衡或热力学和化学平衡的多组分复杂体系的方程组。本章将介绍这种理论分析的基本方法,使读者能够了解目前使用的一些计算机程序的热力学和化学基础。本章不打算叙述具体的计算机分析程序。但是,哪些物理现象或化学反应能够或不能够用计算机分析进行合适的模拟是要进行讨论的。
对于一般的化学和热力学基础知识和原理,读者可以参考文献。要详细了解各种反应物和反应产物的特性,可参见文献。
所有这些理论分析都只是实际火箭发动机燃烧和喷管流动现象的某种近似,它们均需要一些简化假设。随着得到认识和可以进行数学模拟的现象的增多,分析方法和计算机程序越来越高级和复杂。3.1节中对理想火箭发动机所作的11个假设在这儿也同样适用,但只针对准一维流动。然而,一些较复杂的分析方法可以去掉一个或多个假设。整个分析通常可分为两个相对有些独立的计算过程:
(1)燃烧过程是第一部分。它发生在室压基本恒定(等压)的燃烧室中,生成的气体遵循道尔顿定律。化学反应或燃烧的速率非常高。假定燃烧室容积足够大、气体在燃烧室内的停留时间足够长,燃烧室内达到化学平衡。
(2)喷管气体膨胀过程构成了计算的第二部分。经完全反应的、平衡的气体燃烧产物进入喷管,在喷管内经历绝热膨胀。在喷管可逆(等熵)膨胀过程中熵为常数,但在实际喷管流动中熵稍有增加。
化学反应主要发生在液体火箭发动机燃烧室内或固体火箭发动机的药柱空腔内(通常在燃烧面附近短距离范围内)。第九章和第十五章将进一步分析这些燃烧室中的燃烧过程。然而,随着气体的膨胀,喷管内也会出现一些化学反应,因此喷管内反应产物的组分会发生变化,如本章将叙述的。喷管外的排气羽流中可能还会发生进一步的化学反应,这将在第十八章叙述。本章叙述的许多热化学基本分析方法同样也可应用于排气羽流。
5.1 背景和基础知识
一种或多种燃料与一种或多种氧化剂的化学反应或燃烧的原理构成了化学火箭推进的基础。这种反应所释放的热量使推进剂(反应物)转变为高温气态反应产物,这些产物随后在喷管内作热力学膨胀而产生推力。
化学反应物或推进剂在初始状态时既可以是液体,也可以是固体,有时也会是气体。反应产物通常为气态,但有些推进剂的一种或多种反应产物可能保持固态或液态。例如,对于含铝固体推进剂,燃烧室反应气体中含有液体氧化铝,而在温度较低的喷管排气中包含有凝结的固态氧化铝颗粒。因此,对于某些化学组分,分析方法必须考虑所有三种物态,并要考虑相变引起的能量变化。如果排气中固体或液体的含量很少,而且其颗粒很小,则理想气休假设引起的误差很小。
要计算性能,就必须精确了解推进剂的化学成分及其相对比例。对于液体推进剂,这指混合比和主要的杂质;对于胶体或浆状液体推进剂,还包括悬浮或溶解的固体物质;对于固体推进剂,则指所有的成分、它们的比例、杂质以及物态(某些成分如増塑剂可能是液态)。
道尔顿定律适用于燃烧产生的气体。它表述为:在平衡状态和各气体组分温度相同的情况下,气体混合物的压力为各气体组分的分压之和。用下标a、b、c等指各气体组分,有
\(P={{P}_{a}}+{{P}_{b}}+{{P}_{c}}+\cdots \) (5-1)
\(T={{T}_{a}}={{T}_{b}}={{T}_{c}}=\cdots \) (5-2)
理想气体公式pV=RT对高温气体是非常适用的。这里V为比容或单位质量气体混合物的容积,混合物的气体常数R为通用气体常数R [8314.3 J/kg.mol.K]除以气体混合物的平均分子暈M (经常错误地称为分子重量)。利用道尔顿定律,公式5-1可重新写为
\(p={{R}_{a}}T/{{V}_{a}}+{{R}_{b}}T/{{V}_{b}}+{{R}_{c}}T/{{V}_{c}}+\cdots ={{R}^{‘}}T/M{{V}_{mix}}\) (5-3)
在气体混合物中,气体组分的容积比例可以根据摩尔浓度或摩尔分数nj确定,nj表示为每公斤混合物中特定组分j的公斤-摩尔数。如果n为每公斤均匀气体混合物中总的公斤-摩尔数,则
\(n=\sum\limits_{j=1}^{j=m}{{{n}_{j}}}\) (5-4)
式中nj为每公斤混合物中组分j的公斤-摩尔数,m为平衡燃烧气体产物中存在的气体组分数目。于是气体混合物的等效平均分子量M为
\(M=\frac{\sum\limits_{j=1}^{m}{{{n}_{j}}{{M}_{j}}}}{\sum\limits_{j=1}^{m}{{{n}_{j}}}}\) (5-5)
关系式中的组分有n种,其中只有m种为气体,则凝结组分数目为n-m。气体混合物定压下的摩尔比热Cp可根据各种气体的摩尔分数nj及其摩尔比热确定,如公式(5-6)所示。混合物的比热比k也可用类似方法或公式(5-7)确定。
\({{\left( {{C}_{p}} \right)}_{mix}}=\frac{\sum\limits_{j=1}^{m}{{{n}_{j}}{{\left( {{C}_{p}} \right)}_{j}}}}{\sum\limits_{j=1}^{m}{{{n}_{j}}}}\) (5-6)
\({{k}_{mix}}=\frac{{{\left( {{C}_{p}} \right)}_{\min }}}{{{\left( {{C}_{p}} \right)}_{\min }}-{{R}^{‘}}}\) (5-7)
当化学反应完全结束后,所有反应物均耗尽、转变为反应产物,则称反应物处于化学当量比。例如,考虑以下反应式:
\({{\text{H}}_{\text{2}}}\text{+}\frac{\text{1}}{\text{2}}{{\text{O}}_{\text{2}}}\to {{\text{H}}_{\text{2}}}\text{O}\) (5-8)
氢和氧完全耗尽,形成单一产物——水蒸气,没有留下任何氢或氧反应物。在这种情况下,需要1摩尔的H2和1/2摩尔的O2,得到1摩尔的H2O。从质量上讲,该化学当量混合物需要16 kg的O2和2 kg的H2,即化学当量混合物的质量比为8:1。在处于或接近化学当量混合物时,单位质量推进剂混合物所释放的能量和燃烧温度达到最高值。
火箭推进系统中氧化剂和燃料的工作比例通常不是化学当量混合比,而是富燃状态,因为这可以使较轻的分子(如氢)有些不参加反应,以降低反应产物的平均分子量,从而提高比冲[参见公式(3-16)]。对于采用H2和O2推进剂的火箭发动机,高性能发动机的混合物最佳质量比一般在4.5和6.0之间,而不是8.0的化学当量值。
式(5-8)是一可逆化学反应。给水加能量,反应可以反向进行,产生H2和O2,反应式的箭头要反过来。固体推进剂分解为反应产物气体是不可逆的化学反应,液体推进剂燃烧产生气体也是不可逆的。但是,燃烧产物气体之间的反应通常是可逆的。
可逆化学反应中存在化学平衡,此时产物的生成速率正好等于由产物生成反应物的逆向反应速率。一旦达到这种平衡,浓度就不会再发生变化。在式(5-8)中,三种气体可同时存在,其相对比例取决于压力、温度和初始混合物。
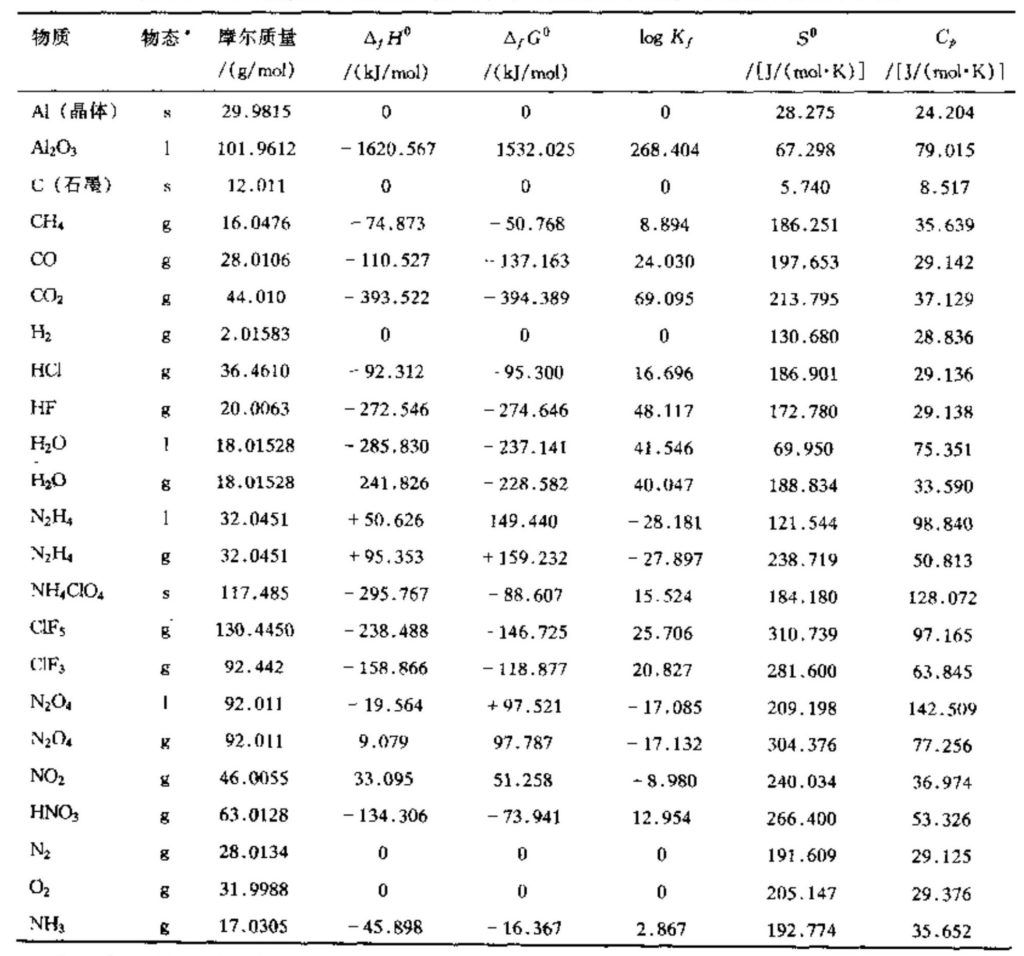
生成热\({{\Delta }_{f}}{{H}^{0}}\)是1摩尔化合物在1 bar(100000 Pa)压力、298.15 K(或25℃)温度下从其构成的原子或元素等温形成时所释放(或吸收)的能量或焓变。符号△意味着它是能量的变化值。下标f指生成物,上标0意味着各产物或反应物均处于其热力学标准状态和基准压力温度条件下。根据惯例,气态元素(如H2、O2、Ar、Xe等)在其标准温度压力条件下的生成热设为零。表5-1给出了几种组分的\({{\Delta }_{f}}{{H}^{0}}\)和其他特性的典型值。当生成产物过程中要吸热时,则\({{\Delta }_{f}}{{H}^{0}}\)为负。早期分析中曾采用了其他标准温度值(如273.15 K)和稍高一些的标准基准压力(l atm)。
反应热\({{\Delta }_{r}}{{H}^{0}}\)是产物在标准基准条件下(即1 bar和25℃)从其反应物生成时所释放或吸收的能量。反应热既可以是负的,也可以是正的,取决于反应是放热的还是吸热的。在其他温度或压力条件下的反应热必须根据焓变作修正。当一种组分从一种物态变为另一种物态时(例如液体变成气体或反过来),它可能失去或得到能暈。大多数火箭发动机中的反应热数据是用于定压燃烧过程的。通常,反应热可以根据产物和反应物的生成热的和来确定,即
表5-l 一些物质在298.15 K (25℃)和0.1MPa(1bar)下的化学热力学性质
|
* s表示固态,l表示液态,g表示气态。有些物质对液态和气态分别列出,其差别在于蒸发或凝结。摩尔质量也可用g/(g.mol)或kg/(kg.mol)表示,Cp也可用J/(g.mol.K)或kJ/(kg.mol.K)表示。 |
\({{\Delta }_{r}}{{H}^{0}}\text{=}{{\sum{\left[ {{n}_{j}}{{\left( {{\Delta }_{f}}{{H}^{0}} \right)}_{j}} \right]}}_{produc\text{ts}}}-{{\sum{\left[ {{n}_{j}}{{\left( {{\Delta }_{f}}{{H}^{0}} \right)}_{j}} \right]}}_{reactants}}\) (5-9)
式中nj为各特定组分j的摩尔分数。在典型的火箭发动机推进剂中,同时进行的化学反应有很多,式(5-9)给岀了所有这些同时进行的反应的反应热。关于生成热和反应热的数据可参见文献。
用于表示稳定平衡状态的充分必耍条件的各种热力学准则最早是由J.W.吉布斯 (Gibbs)在20世纪初提出的,它们基于最小自由能原理。吉布斯自由能G (经常称为化学潜能)是一种很容易导出的函数或化学物质状态特性,它用于描述物质的热力学势,与内能U、压力P、摩尔容积V、焓h、温度T和熵直接相关。某单一组分j的自由能定义为Gj。它可根据特定的热力学状态确定,既可针对气体混合物,也可针对单一气体组分。
\(G=U+\text{ }pV-TS\text{ }=\text{ }h-TS\) (5-10)
现已获得了大多数火箭推进剂的自由能数据,并整理为温度的函数形式。自由能可以根据压力进行修正,其单位为J/(kg.mol.K)。多组分混合物的自由能G为
\(G=\sum\limits_{j=1}^{n}{{{G}_{j}}{{n}_{j}}}\) (5-11)
自由能是温度和压力的函数,它是物质的一个特性,就像焓或密度一样,表征某一气体状态只需要两个这样的独立参数。自由能可以看作是化学物质参与化学(或物理)变化的倾向或驱动力。它虽然不能直接测量,但化学势的差可以测量。当反应物的化学势高于可能的产物的化学势时,则化学反应发生,且化学成分会变化。对于等温等压下的反应,自由能的变化∆G为产物的化学势减去反应物的化学势。
\(\Delta G\text{=}\sum\limits_{j=1}^{m}{{{\left[ {{n}_{j}}{{\left( {{\Delta }_{f}}{{G}^{0}} \right)}_{j}} \right]}_{produc\text{ts}}}}-{{\sum\limits_{j=1}^{n}{\left[ {{n}_{j}}{{\left( {{\Delta }_{f}}{{G}^{0}} \right)}_{j}} \right]}}_{reactants}}\) (5-12)
这里上标m为燃烧产物中的气体组分数目,上标n为反应物中的气体组分数目,∆G表示能对”开式”系统“自由”做功的最大能量,开式系统为有质量进入和离开的系统。在平衡状态,自由能达到最小值。在自由能最小时,混合物各分数的微小变化几乎对∆G没有影响,产物和反应物的自由能基本上相等。即
\(\text{d}\Delta G\text{/d}n=0\) (5-13)
且摩尔浓度n与∆G的关系曲线也达到最小值。
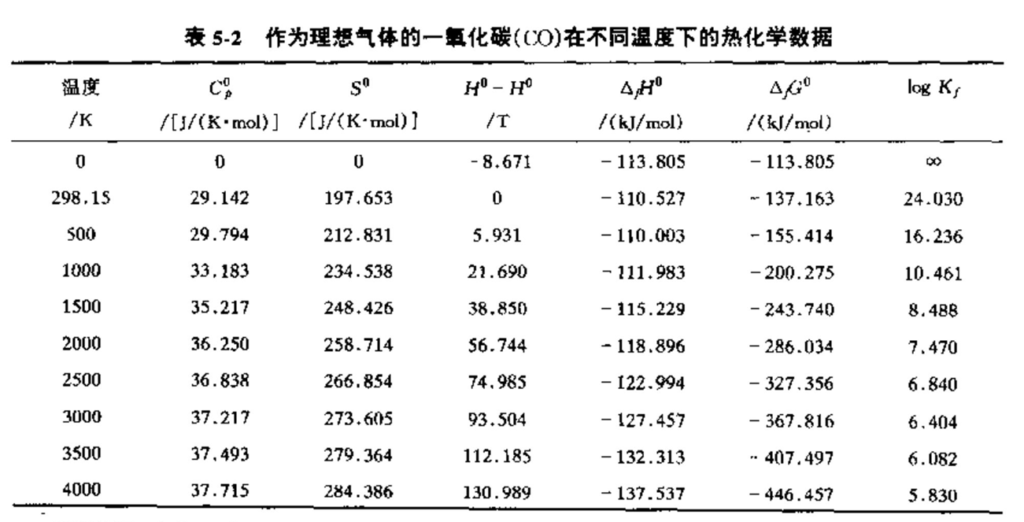
若反应推进剂为液体或固体物质,改变其物态、将其蒸发或分解成其他气体组分均需要能量。这部分能量必须从可用于将气体从基准温度加热到燃烧温度的热量或能量中扣掉。因此,液体和固体组分的\(\Delta {{H}^{0}}\)和\(\Delta {{G}^{\text{0}}}\)值与其气态组分的值是不同的。标准的生成自由能\({{\Delta }_{f}}{{G}^{\text{0}}}\)为一自由能增量,它与在基准状态下从元素形成化合物或组分的反应有关。表5-2给出了一氧化碳的\({{\Delta }_{f}}{{H}^{\text{0}}}\)和\({{\Delta }_{f}}{{G}^{\text{0}}}\)以及其他物性在各种温度下的值。其他组分类似的数据可以从文献和中査到。熵也是物质的一个热力学性质,它是一个相对量,即它只有变化量。在等熵喷管流动分析中,熵假设保持不变。熵的变化定义为
\(\text{d}S=\frac{\text{d}U}{T}+\frac{p\text{d}V}{T}={{C}_{p}}\frac{\text{d}T}{T}-R\frac{\text{d}p}{p}\) (5-14)
其相应积分为
\(S-{{S}_{0}}={{C}_{p}}\ln \frac{T}{{{T}_{0}}}-R\ln \frac{p}{{{p}_{0}}}\) (5-15)
式中下标“0”表示参考状态。在等熵过程中,熵为常数。混合物的熵为
\(S=\sum\limits_{j=1}^{n}{{{S}_{j}}{{n}_{j}}}\) (5-16)
这里熵的单位为J/(kg.mol.K)。各气体组分的熵为
\({{S}_{j}}={{\left( S_{T}^{0} \right)}_{j}}-R\ln \frac{{{n}_{j}}}{n}-R\ln p\) (5-17)
对于固体和液体组分,上式中最后两项为零。上式中\(\left( S_{T}^{0} \right)\)指在温度T下标准状态的熵值。熵的典型值列于表5-1和5-2。
当化学反应处于平衡时,存在一个平衡常数,它能把组分分压和摩尔分数联系起来。例如,有以下一般反应:
\(aA+bB\rightleftharpoons cC+dD\) (5-18)
a、b、c和d为化学分子(或原子)A、B、C和D的化学当量摩尔浓度系数。用分压表示的平衡常数K为温度的函数:
\({{K}_{p}}=\frac{p_{C}^{c}p_{D}^{d}}{p_{A}^{a}p_{B}^{b}}p_{0}^{c\text{+}d-a-b}\) (5-19)
式中p0为参考压力。所有压力单位均为bar或105 Pa。当a + b = c + d 时, KP与压力无关。对于式(5-8)那样的反应,平衡常数与压力是有关的。在这种情况下,增加压力将驱动平衡反应向减少摩尔数的方向发展,若温度増加的话则向吸热的方向发展。对于式(5-8),氢和氧的平衡关系为
\({{K}_{p}}=\frac{{{p}_{{{\text{H}}_{\text{2}}}\text{O}}}}{{{p}_{{{\text{H}}_{\text{2}}}}}p_{{{\text{O}}_{\text{2}}}}^{\text{0}\text{.5}}}p_{0}^{\text{1-1-0}\text{.5}}\) (5-20)
平衡常数也可用摩尔分数nj表示,因为各分压pnj等于发生反应时的实际压力p乘以其摩尔分数(pj=pnj)。根据式(5-19),平衡常数K也可表示为
\({{K}_{n}}=\frac{n_{C}^{c}n_{D}^{d}}{n_{A}^{a}n_{B}^{b}}{{\left( p\text{/}{{p}_{0}} \right)}^{c+d-a-b}}\) (5-21)
某组分从其元素生成化合物的过程中的平衡常数记为Kf。表5-1和5-2给出了典型的Kf值。特定组分在标准条件下从其原子元素形成化合物的过程中的自由能和平衡常数是有联系的,即
\(\Delta {{G}^{0}}=-RT\ln {{K}_{f}}\) (5-22)
式(5-19)、(5-20)和(5-22)常与质量平衡和能量平衡关系式一起使用,方程组同时求解。平衡常数K主要在元素形成化合物时使用。
5.2 燃烧室或发动机状态分析
本节的目的是确定理论燃烧温度以及反应产物的理论组分,由此可确定燃气物性(Cp、k或ρ)。在作这种分析之前,必须知道或设定一些基本数据,如推进剂及其成分、预定室压或所有可能的反应产物。虽然燃烧过程实际上包含了一系列几乎同时发生的化学反应,且包括化合物分裂成中间产物和其后的最终产物的过程,但分析只关心燃烧前后的初始和最终状态。本章将叙述分析燃烧室状态的几种方法。本节首先要给出一些关键术语的定义,并解释一些概念和原理。第一个原理即能量守恒。燃烧产生的热量等于将所产生的燃气的温度绝热地上升到其最终燃烧温度所需的热量。燃烧反应热\({{\Delta }_{r}}H\)应等于燃气的焓变\(\Delta H\)。
能量平衡可以视为两步过程。化学反应在基准温度下瞬时、等温地完成,然后所产生的能量将气体从基准温度加热到最终燃烧温度。反应热为
\({{\Delta }_{r}}H=\sum\limits_{1}^{n}{{{n}_{j}}\int_{{{T}_{ref}}}^{{{T}_{1}}}{{{C}_{p}}\text{d}T}}=\sum\limits_{1}^{n}{{{n}_{j}}\Delta {{h}_{j}}}|_{{{T}_{ref}}}^{{{T}_{1}}}\) (5-23)
这里∆h为各组分的焓增乘以其摩尔分数,Cp为定压摩尔比热。
第二个原理为质量守恒。化学反应前反应物中存在的任何原子组分的质量应等于产物中同一组分的质量。这可以用式5-8表示的一般反应来说明。此例中反应物不在化学当量比状态。
氢与氧燃烧可形成六种产物:水、氢、氧、氢氧基、原子氧和原子氢。此例中反应物和产物均为气态。理论上还有两种附加产物:臭氧O3和过氧化氢H2O2。但它们是不稳定的物质,在高温下不易存在,因此可以忽略。化学反应可用符号表述为
\(a{{\text{H}}_{2}}+b{{\text{O}}_{\text{2}}}\to {{n}_{{{\text{H}}_{\text{2}}}\text{O}}}{{\text{H}}_{\text{2}}}\text{O+}{{n}_{{{\text{H}}_{\text{2}}}}}{{\text{H}}_{\text{2}}}\text{+}{{n}_{{{\text{O}}_{\text{2}}}}}{{\text{O}}_{\text{2}}}\text{+}{{n}_{\text{O}}}\text{O+}{{n}_{\text{H}}}\text{H+}{{n}_{\text{OH}}}\text{OH}\) (5-24)
左边和右边分别表示反应前和反应后的状态。由于两边都有H2和O2,这意味着这些组分没有完全耗尽,有一部分没有反应,即\({{n}_{{{\text{H}}_{\text{2}}}}}\)和\({{n}_{{{\text{O}}_{\text{2}}}}}\)在特定的温度和压力下达到化学平衡时,右边的摩尔浓度将保持固定。这里a、b、\({{n}_{{{\text{H}}_{\text{2}}}\text{O}}}\)、\({{n}_{{{\text{H}}_{\text{2}}}}}\)、\({{n}_{{{\text{O}}_{\text{2}}}}}\)、no、nH和nOH是这些物质在反应前后各自的摩尔分数或摩尔量,它们可表示为每公斤推进剂反应物或反应产物中的kg.mol数。初始系数a和b通常是已知的。各元素在每公斤混合物中的kg.mol数可以根据该氧化剂和燃料的初始混合物确定。对于上面的氢-氧关系式,质量平衡为
\(\text{2}a\to \text{2}{{n}_{{{\text{H}}_{\text{2}}}\text{O}}}\text{+2}{{n}_{{{\text{H}}_{\text{2}}}}}\text{+}{{n}_{\text{H}}}\text{+}{{n}_{\text{OH}}} \)
\(\text{2}b\to {{n}_{{{\text{H}}_{\text{2}}}\text{O}}}\text{+2}{{n}_{{{\text{O}}_{\text{2}}}}}\text{+}{{n}_{\text{O}}}\text{+}{{n}_{\text{OH}}} \) (5-25)
除能量平衡 公式外,式(5-25)的质量平衡给出了该反应的另外两个公式(两个原子组分各一个〉。这里有6个未知的产物百分比和1个未知的燃烧温度或平衡温度,但是3个公式只能提供3个未知数的解,比如燃烧温度和两个组分的摩尔分数。若已知(假设)初始质量混合比b/a是富燃的,则燃烧温度较低,剰余的O2和离解产物(O、H和OH)的百分数将是很低的,可以忽略。因此nO、nH、nOH和\({{n}_{{{\text{O}}_{\text{2}}}}}\)可设为零。求解时需要知道各组分的焓变,这方面的信息可以从现成的表格(如表5-2)或文献和中获得。
在更一般的形式中,任何特定元素的质量在反应前后必须相同,每公斤反应物和产物中特定元素的kg.mol数应相等,或其差值为零。对于任何一种原子组分,如式(5- 25)中的H或O,有
\({{\left[ \sum\limits_{j=1}^{m}{{{a}_{ij}}{{n}_{j}}} \right]}_{products}}-{{\left[ \sum\limits_{j=1}^{n}{{{a}_{ij}}{{n}_{j}}} \right]}_{propellants}}=0\) (5-26)
这里原子系数aij为每kg.mol的组分j中i种元素的kg数, m和n的定义同前。式 (5-19)中产物的平均分子量为
\(M=\frac{\text{2}{{n}_{{{\text{H}}_{\text{2}}}}}\text{+32}{{n}_{{{\text{O}}_{\text{2}}}}}\text{+18}{{n}_{{{\text{H}}_{\text{2}}}\text{O}}}\text{+16}{{n}_{\text{O}}}\text{+}{{n}_{\text{H}}}\text{+17}{{n}_{\text{OH}}}}{{{n}_{{{\text{H}}_{\text{2}}}}}\text{+}{{n}_{{{\text{O}}_{\text{2}}}}}\text{+}{{n}_{{{\text{H}}_{\text{2}}}\text{O}}}\text{+}{{n}_{\text{O}}}\text{+}{{n}_{\text{H}}}\text{+}{{n}_{\text{OH}}}}\) (5-27)
确定平衡组分的摩尔分数的另一种方法是采用化学反应进度的因子λ。该因子λ在反应开始之前的初始状态下为0,在反应完成、所有反应气体转变为产物气体的最终状态时为1。对于式(5-24)描述的反应,λ的应用如下:
A的摩尔数\({{n}_{A}}=a\lambda \) (5-28)
B的摩尔数\({{n}_{B}}=b\lambda \)
C的摩尔数\({{n}_{C}}=c(1-\lambda )\) (5-29)
D的摩尔数\({{n}_{D}}=d(1-\lambda )\)
将这些摩尔数代入吉布斯自由能公式[式(5-12)],然后对λ求导,并设导数\(\text{d}G\text{/d}\lambda =0\),这样就可确定气体混合物的G值最小时的λ值。此时进度λ决定了平衡时的nA、nB、nC 和nD值。
目前热化学分析普遍采用文献所用的方法。它利用了最小吉布斯自由能及质量平衡和能量平衡公式。如式(5-12)所解释的,平衡时吉布斯自由能函数的变化为零\(\left( \Delta G=0 \right)\):气态推进剂的化学势必须等于气态反应产物的化学势[即公式(5-12)]。故
\(\Delta G\text{=}\sum{{{\left( {{n}_{j}}\Delta {{G}_{j}} \right)}_{produc\text{ts}}}}-\sum{{{\left( {{n}_{j}}\Delta {{G}_{j}} \right)}_{reactants}}}=\text{0}\) (5-30)
为了便于求解该公式,常采用一个拉格朗日乘数或反应进度系数。求解气体组分、温度和气体性质的另一种方法是采用与若干质量平衡[式(5-26)]联系在一起的能量平衡[式(5-23)]和反应平衡关系式[式(5-21)]o
设定燃烧室压力并建立能量平衡、质量平衡和反应平衡关系后,求解所有方程的一种方法是先估计一个燃烧温度,随后求解各个nj值。然后反应热\({{\Delta }_{r}}{{H}^{0}}\)与燃气从基准温度加热到燃烧温度所吸收的热量\(H_{T}^{0}-H_{0}^{0}\)之间必须达到平衡。若它们没有平衡,则选择另一个燃烧温度值,直至收敛和能量平衡为止。
能量释放效率(有时称为燃烧效率)现可定义为单位推进剂混合物的实际焓变与将推进剂从初始状态转变为在燃烧室温度和压力下的产物所需的理论焓变之比。如果能测得推进剂初始状态和燃气的实际组分与温度,就可以计算实际焓变。但燃烧温度和燃气组分难以通过实验精确测量,因此能计算燃烧效率的情况实际上很少。液体火箭发动机推力室的燃烧效率取决于喷射和混合的方法,并且随燃烧温度的提高而提高。对于固体推进剂,燃烧效率是药柱设计、推进剂以及几种固体成分混合程度的函数。设计良好的火箭推进系统的实测燃烧效率为94%~99%。这样高的燃烧效率值表示燃烧基本上是完全的,即使有未反应的推进剂,其量也是非常少的,确实达到了化学平衡。
固体推进剂或含某些添加剂的液体推进剂的排气中的化合物或组分的数目在50种以上。必须考虑的几乎同时发生的化学反应的数目很容易超过150。所幸的是许多化学组分的含量极小,通常可以忽略。
5.3 喷管膨胀过程分析
现有多种喷管流动分析方法,他们对化学平衡、喷管膨胀、颗粒或能量损失采取了不同的假设。表5-3概述了其中一些方法的要点。

燃气进入喷管后将经历绝热的可逆膨胀过程,伴随有温度和压力的下降,同时热能转变为动能。用于分析膨胀过程的方法越来越复杂。对于一维冻结流动这种简单的情况,整个喷管中气体的状态是由系统的熵决定的,假设熵在压力降低到喷管出口平面的值的过程中保持不变。第三章列出的理想火箭发动机的假设在这里都适用。此外,在简单情况中还忽略了摩擦、扩张角、热交换、激波或非平衡的影响,但它们在更精确的解中都考虑进去了。此外还假设凝结物(液体或固体)的容积为零,并与流动气体之间保持动力学和热的平衡。这意味着固体颗粒或液滴的尺寸非常小,运动速度与气流相同,其温度与喷管各处的气体相同。
喷管内气流膨胀过程的化学平衡可以按以下途径分析:
(1) 整个喷管内气体组分不变,没有化学反应和相变,喷管出口处产物的组分与燃烧室相同。这种结果称为冻结发动机性能。这种方法通常比较简单,但性能一般低估1%〜4%。
(2) 在喷管膨胀过程中,随着压力和温度的连续变化,所有组分之间均随时保持化学平衡。这样,燃烧产物的组分是变化的,所有排气组分之间存在瞬间化学反应,气相和凝结相之间存在瞬间相变或平衡。这样计算的结果称为平衡性能,气体组分质量百分数在燃烧室和喷管出口处是不同的。这种方法通常使性能值(如C*或Is)高估了1%〜4% 。这种分析比校复杂。
(3) 化学反应不是瞬间发生的。尽管反应很迅速,但它们也需要一定的时间。特定反应的反应速率可以计算。反应速率通常与温度、偏离平衡摩尔组分的程度以及化合物或反应的性质有关。对于这种平衡分析, T、C*或Is值通常介于冻结平衡和移动平衡之间。由于缺乏同时发生的多个化学反应的反应速率的合适数据,这种方法几乎从未用过。
对于轴对称喷管,可以使用一维和两维分析。最简单的喷管流动分析是一维的,这意味着轴对称喷管任何横截面上各处的速度、温度或压力均是相等的。对于初步计算,这通常已令人满意。在两维分析中,速度、温度、密度和/或马赫数的分布不 是平坦的,它们沿横截面发生一些变化。对于非旋成体形状的喷管(如矩形、斜切的或椭圆形的),需要作三维分析。
如果喷管气流中存在固体颗粒或液滴,而且颗粒平均直径大于,则将存在热滞后和速度滞后。固体颗粒或液滴不会像气体那样膨胀,它们的温降取决于对流或辐射散失的能量,而其速度取决于作用在颗粒上的阻力。直径较大的液滴或颗粒的加速没有像小颗粒那么快,其流动速度低于邻近的加速流动的气体。此外,颗粒温度高于气体,它对气体传递热量。尽管这些颗粒的动量构成了排气动量的一部分,但它们的效率不如全气态排气。对于排气中含铝颗粒的复合固体推进剂,由颗粒引起的损失一般为1%〜3%。两相或三相流分析需要知道非气相物质的知识或作出有关的假设,包括尺寸(直径)、尺寸分布、形状(通常假设为球形)、表面光学特性(用于确定辐射能量的反射/吸收或散射)以及它们的凝结或冻结温度。这些参数中有些不是很清楚。3.5节阐述了带颗粒流动的性能计算。
紧贴喷管壁面的黏性边界层的速度比无黏自由流低得多。由于黏性阻力引起的壁面附近气流的减速实际上使动能转变为热能,因此边界层内某些部分的温度可能比当地自由流的静温要高。图3-16示出了两维边界层的简图。由于湍流,大直径喷管中这种边界层会比较厚。边界层还与喷管内轴向压力梯度、喷管形状(特别是喉部区的形状〉、表面粗糙度或对喷管壁的传热有关。目前,带不稳定流动的边界层理论分析只是近似的,但随着我们对该现象的认识和CFD方法的发展,预计今后会有改进。边界层产生的总效应是不均匀的速度和温度分布、黏性层内的不可逆摩擦过程以及熵增和排气动能稍有降低(逋常小于5%)。贴近喷管壁面的缓慢流动层处于层流和亚声速状态。
在很高的燃烧温度下,一小部分燃气分子会发生离解(分裂为更简单的组分)。在这种离解过程中,一些能量被吸收。当能量在复合期间(在喷管中较低压力和温度处)释放时降低了喷管出口处的排气动能。这将在下一节进一步讨论。
对于只产生气态产物的推进剂,喷管内会释放出额外的能量,它主要来自于原子和自由基组分的复合,这些组分随喷管膨胀过程中温度的下降而变为不稳定的。有些推进剂产物组分会随喷管膨胀过程中温度的降低而凝结。如果凝结的释热量很大,则冻结流和平衡流的性能差别会很大。
在最简单的方法中,出口温度根据认为熵为常数的等熵过程(冻结流)确定。喷管出口处的熵与燃烧室中的熵相同,由此可确定出口处的温度和气体状态。根据相应的焓变就可得到排气速度和比冲。对于喷管流动过程不等熵、膨胀过程只是部分可逆的那些分析,必须考虑由摩擦、激波、湍流等引起的损失。这样得到的喷管岀口平均温度稍微高一些,比冲有轻微的损失。表5-3给出了可用于分析喷管过程的一组步骤。
当燃烧室(或药孔面积)与喉部面积之间的收缩比很小时\(\left( {{A}_{p}}\text{/}{{A}_{t}}\le \text{3} \right)\),燃烧室内 燃气的加速会引起喷管进口处有效室压下降。这种燃烧压力损失使c和Is值轻微降低。文献论述了这种燃烧室构型的分析,表3-2和6-4中给出了一些筒要数据。
例题5-1 ―种称为硝基甲烷\(\left( \text{C}{{\text{H}}_{\text{3}}}\text{N}{{\text{O}}_{\text{2}}} \right)\)的液体单组元推进剂巳做了各种实验,它会 分解为气态反应产物。试利用水煤气平衡条件确定T、M、k、c*、CF和Is值。假设无离解、无O2。
解 1 mol反应物的化学反应可以表述为
\(\text{1}\text{.0C}{{\text{H}}_{\text{3}}}\text{N}{{\text{O}}_{\text{2}}}\to {{n}_{\text{CO}}}\text{CO+}{{n}_{\text{C}{{\text{O}}_{\text{2}}}}}\text{C}{{\text{O}}_{\text{2}}}\text{+}{{n}_{{{\text{H}}_{\text{2}}}}}{{\text{H}}_{\text{2}}}\text{+}{{n}_{{{\text{H}}_{\text{2}}}\text{O}}}{{\text{H}}_{\text{2}}}\text{O+}{{n}_{{{\text{N}}_{\text{2}}}}}{{\text{N}}_{\text{2}}}\)
忽略其他较少的产物。各原子的质量平衡如下:
\(C:1={{n}_{CO}}+{{n}_{\text{C}{{\text{O}}_{\text{2}}}}}\)
\(\text{H:3=2}{{\text{n}}_{{{\text{H}}_{\text{2}}}}}\text{+2}{{n}_{{{\text{H}}_{\text{2}}}\text{O}}}\)
\(\text{O:2=}{{\text{n}}_{\text{CO}}}\text{+2}{{n}_{\text{C}{{\text{O}}_{\text{2}}}}}\text{+}{{n}_{{{\text{H}}_{\text{2}}}\text{O}}}\)
\({{n}_{{{\text{N}}_{\text{2}}}}}\text{=0}\text{.5}\)
一般称为水煤气反应的反应式为
\({{\text{H}}_{\text{2}}}\text{+C}{{\text{O}}_{\text{2}}}\rightleftharpoons \text{CO+}{{\text{H}}_{\text{2}}}\text{O}\)
其平衡常数K(用摩尔浓度表示)为温度的函数:
\(K=\frac{{{n}_{{{\text{H}}_{\text{2}}}\text{O}}}{{n}_{\text{CO}}}}{{{n}_{{{\text{H}}_{\text{2}}}}}{{n}_{\text{C}{{\text{O}}_{\text{2}}}}}}\)
上面五个公式有六个未知数:即五个摩尔浓度和K。求解\({{n}_{{{\text{H}}_{\text{2}}}}}\)和K:
\(\left( K-1 \right)n_{{{\text{H}}_{\text{2}}}}^{2}-\left( 3-K\text{/2} \right){{n}_{{{\text{H}}_{\text{2}}}}}=2.25\)
K可以根据温度从水煤气反应表查得。试设T=2500K,K=6.440,代入上式
\(\text{5}\text{.440}n_{{{\text{H}}_{\text{2}}}}^{2}-\text{0}\text{.220}{{n}_{{{\text{H}}_{\text{2}}}}}-2.25=0\)
则
\({{n}_{{{\text{H}}_{\text{2}}}}}=0.664\)
\({{n}_{{{\text{H}}_{\text{2}}}\text{O}}}=1.500-{{n}_{{{\text{H}}_{\text{2}}}}}=0.836\)
\({{n}_{\text{C}{{\text{O}}_{\text{2}}}}}=\text{0}\text{.164}\),\({{n}_{\text{CO}}}=0.836\)
各组分的生成热\({{\Delta }_{j}}{{H}^{0}}\)列于下表[摘白JANAF热化学表(文献和)]。反应热根据公式(5-9)得到,单位为kJ/mol。根据定义,H2或N2的生成热为零。根据公式 (5-9)得
\({{\Delta }_{j}}{{H}^{0}}={{\sum{\left( n{{\Delta }_{f}}H \right)}}_{\text{products}}}-{{\left( {{\Delta }_{f}}{{H}^{0}} \right)}_{\text{reac}\tan \text{t}}}\)
\(=0.836(-241.8)\text{ }+0.164(-393.5)\text{ }+0.836(-110.5)-1.0(-113.1)\)
\(=-246\text{kJ/mol}\)
气体从基准温度变到燃烧温度的焓变也可以从文献和的表中查到,下面把它们列出。

燃烧室中燃气的焓变在数值上等于生成热。利用上表数据得
\(\Delta H_{298}^{2500}=\sum{{{n}_{j}}\Delta {{h}_{j}}=249.5\text{kJ/mol}}\)
这与前面得到的\(246\text{kJ/mol}\)不一祥,因此需再试较低的温度。一次或两次迭代后,可 以得到最终燃烧温度为2470K,此时反应热与焓升平衡。前面得到的组分与新的温度下得到的组分近似相同。然后根据公式(5-5)可以得到分子量:
\(M=\frac{\sum{{{n}_{j}}M}}{\sum{{{n}_{j}}}}\)
\(=\frac{28\times 0.5+18\times 0.836+2\times 0.664+28\times 0.836+44\times 0.164}{2\times \left( 0.836 \right)+0.664+0.164+0.500}\)
=20.3
比热随温度而变化,各组分的平均比热值\(\overset{-}{\mathop{{{C}_{p}}}}\,\)可以通过积分得到。
\(\overset{-}{\mathop{{{C}_{p}}}}\,=\frac{\int_{298}^{2470}{{{C}_{p}}\text{d}T}}{\int_{298}^{2470}{\text{d}T}}\)
CP值可以从文献的表中得到。如果不用计算机的话,枳分也可以用图线法来做。结果为
\(\overset{-}{\mathop{{{C}_{p}}}}\,=\text{41400kJ/K}\cdot \text{mol/20}\text{.3=2040kJ/K}\cdot \text{kg}\)
根据公式(3-4),比热比k为
\(k=\frac{{{C}_{p}}}{{{C}_{p}}-{{R}^{‘}}}=\frac{41440}{41440-8314}=1.25\)
用刚才确定的M、k和T,可以根据公式(3-16)、(3-30)和(3-32)求得\({{p}_{1}}=69\text{atm}\)、\({{p}_{\text{2}}}=\text{1}\text{.0atm}\)时硝基甲烷火箭发动机的理论性能。结果为
\({{c}^{*}}=1525\left( \text{m}/\text{s} \right)\)
\({{C}_{F}}=1.57\)
\(c=1.57\times 1525=2394\left( \text{m}/\text{s} \right)\)
\({{I}_{s}}=2394\text{/}9.80=244\left( \text{s} \right)\)
5.4 计算机分析
本章所讨论的方法目前都是用计算机程序进行汁算的。大多数分析基于最小自由能,这是一种比平衡常数法更简单的方法,平衡常数法是在许多年前使用的。一旦确定了nj和T1的值,就可以计算气体的分子量[公式(5-5)],平均摩尔比热Cp(用类似公式)和比热比k[公式(3-6)和(5-7)]。于是这就表征了燃烧室内的热力学状态。有了这些数据,就可以计算c*、R和其他燃烧参数。通过喷管膨胀过程的计算机模拟,得到性能(如Is、c和A2/At)和喷管中的气体状态。通常程序中还包括第三章提到的一些修正。现有一维、两维和三维流动模型的计算程序。
更精确的解法对流速很高的燃烧室状态作了进一步分析(参见文献),考虑了边界层、传热或喷管任意横截面上流动特性不均匀的两维轴对称流动。通常忽略燃烧室内的时间相关化学反应,但它们可以用估计的反应速率来分析。一种方法是计算反应进度的时间导数\(\text{d}\lambda \text{/d}t\),然后把该导数设为零。文献对此作了叙述。
一个常用的计算机程序实例是NASA Lewis实验室开发的基于化学平衡组分的程 序,文献第1卷和第2卷对此作了叙述。该程序的主要假设是一维形式的连续方程、能量方程和动量方程,燃烧室前端流动速度为零,喷管内的膨胀为等熵,采用理想气体定律以及燃烧室内化学平衡。该程序还可以选择使用冻结流和细长燃烧室(对于液体推进剂燃烧)或小横截面枳的药孔(对固体推进剂装药)等,后两种情况下燃烧室流动速度很高,引起额外的压力损失和轻微的性能损失。
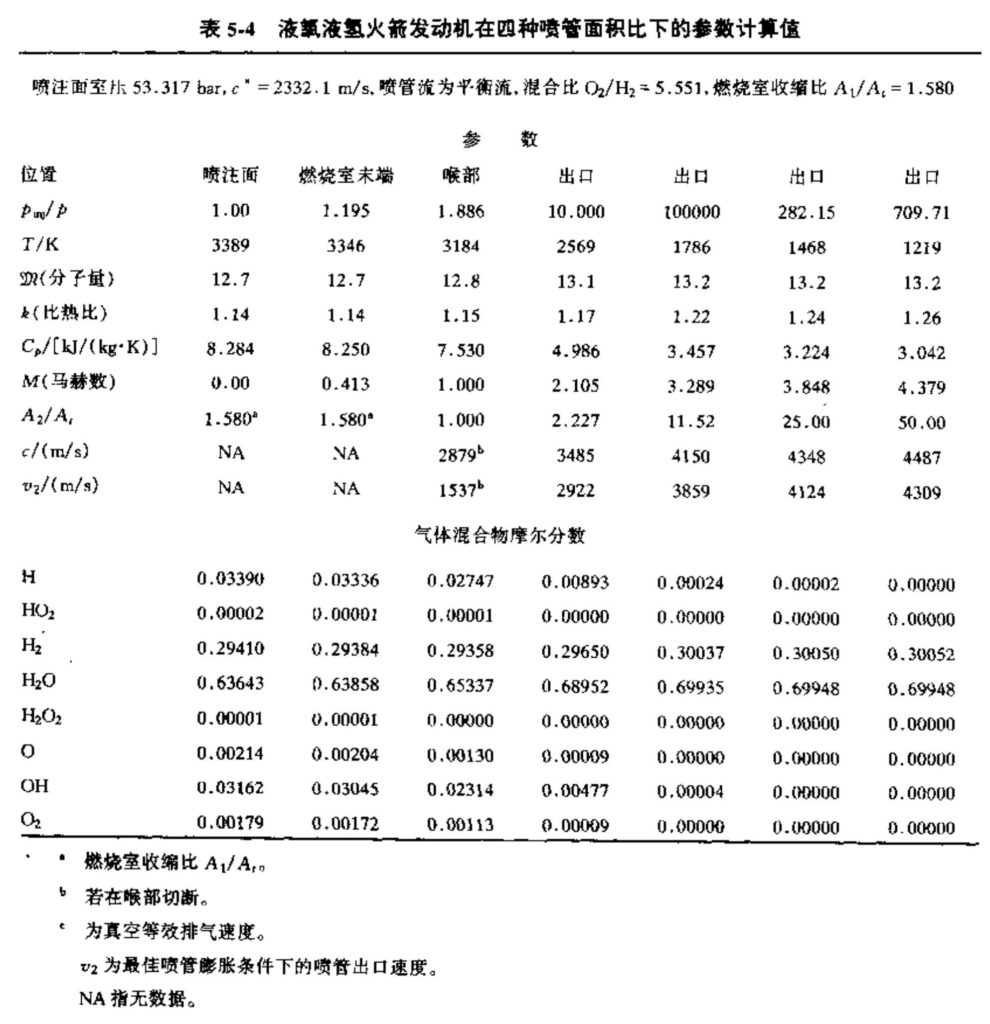
表5-4给出了液氢液氧推力室的计算数据,取自该文献中的一个实例。喷管流动采用了平衡流假设。细长燃烧室的横截面积只比喉部面积略大一些。燃烧室内压降较大(约126 psi)是因为加速气体需要能量,如3.3节和表3-2中所讨论的。
表5-4 液氧液氢火箭发动机在四种喷管面积比下的参数计算值
5.5 热化学计算结果
存在大量的计算机计算结果,这里仅列举几例用以说明各种参数变化产生的典型影响。一般来说,如果反应产物的平均分子量较小(通常这意味着分子式富氢)或者可用化学能(反应热)较大(这意味着燃烧温度较高),就可以得到较高的比冲或c*值[参见公式(3-16)]。
比冲的理论计算值要比发动机实际试车值高。实践中发现实验值一般比本章叙述的方法计算得到的值低3%〜12%。考虑到第三章叙述的喷管效率,该偏差中只有一部分(或许为1%〜4%)是由于燃烧不良引起的。
图5-1〜5-6示出了液氧/RP-1液体推进剂组合的性能计算值。数据取自文献和。RP-1是一种窄镏分的烃类燃料,类似于煤油,平均每摩尔碳对应1.953摩尔的氢,因此其名义分子式为CH1.953。计算室压为1000 psi。大多数曲线对应于大气压(即latm)下的最佳面积比以及有限范围的氧化剂/燃料混合比。
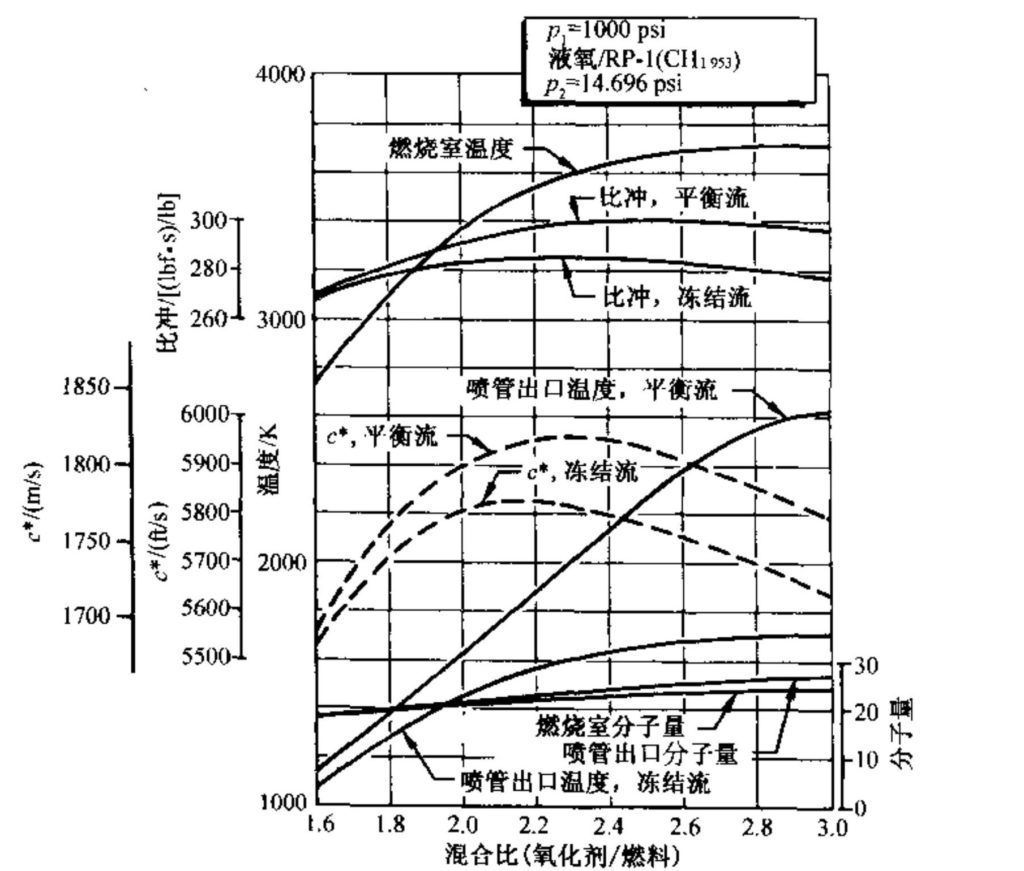
图5-1和图5-4表明,在气体膨胀至海平面压力时,最高比冲对应的最佳混合比对于冻结流约为2.3(每kg/s的氧化剂流量除以kg/s的燃料流量),而对于平衡流约为2.5。对应于c*最大值的混合比稍有不同。这个最佳混合比并不是最高温度的对应值,最高温度的混合比值通常与化学当量比很接近。化学当量混合比在3.0以上,大部分碳燃烧成CO2,几乎所有氢都形成H2O。
由于在平衡流条件下更多的焓能够转化为动能,因此在同样的出口压力下它得到的性能值较高(Is或c*较高)、喷管出口温度较高(参见图5-1)。从图5-2可见,混合比对燃烧室燃气组分的影响是很明显的。与图5-3的比较表明,在平衡流条件下燃气组分随气体膨胀有显著的变化。图5-6示出了气体膨胀程度或喷管出口压力对气体组分的影响。随着面积比的増加、气体膨胀到更低的出口压力(或更高的压比),推力室的性能提高。但是,随着压比的进一步増加,性能的増加越来越慢(参见图5-5和5-6)。
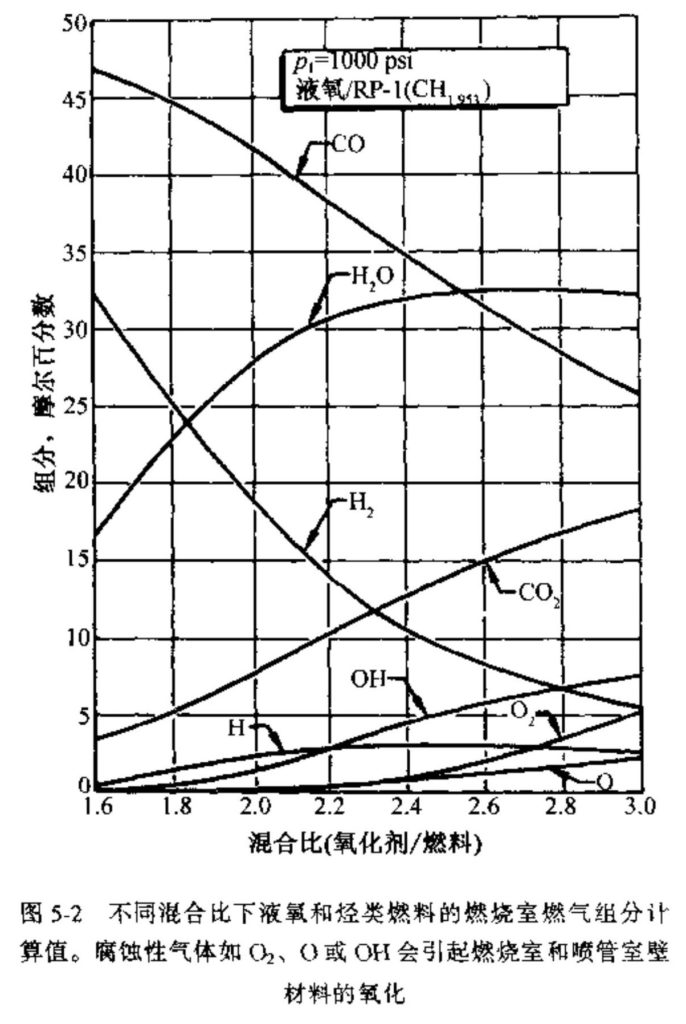
分子离解需要消耗相当大的能量,因此造成燃烧温度的降低,从而降低了比冲。反应产物的离解随燃烧室温度的升高而増加,随室压的增加而降低。如从图5-2可以看到,燃气中形成了原子或自由基(如单原子O或H和OH),在较高的混合比和很高的燃烧温度下还会有一些未反应的O2。随着气体温度在喷管膨胀过程中的降低,离解组分又反应形成分子,并释放热量给流动气体。如从图5-3可以看到,只有在高混合比下,喷管出口处才有离解组分,且其百分数很小。在高混合比下,喷管岀口温度较高(平衡流条件下的出口温度参见图5-1)。超声速流中的放热实际上使马赫数降低。
表5-5和5-6给出了一些液体和固体推进剂组合的计算结果。对于液体推进剂组合,所列出的混合比是最佳的,其性能是最大值。对于固体推进剂,由于一些实际考虑因素(如推进剂物性),推进剂装药的成分不见得总是能根据最佳性能的比例混合(黏合剂不足),因此表5-6所列的固体推进剂数据部分对应于具有较好的物性和内弹道特性的实际配方。
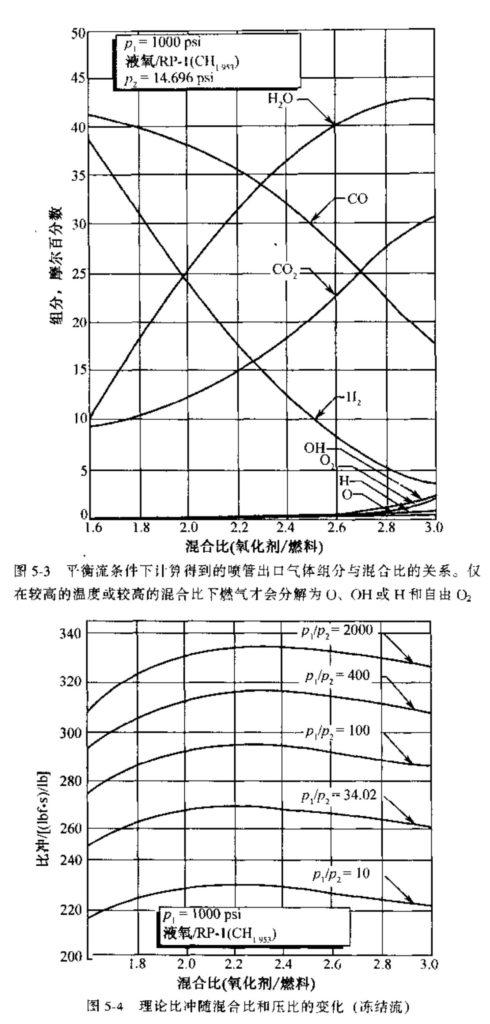

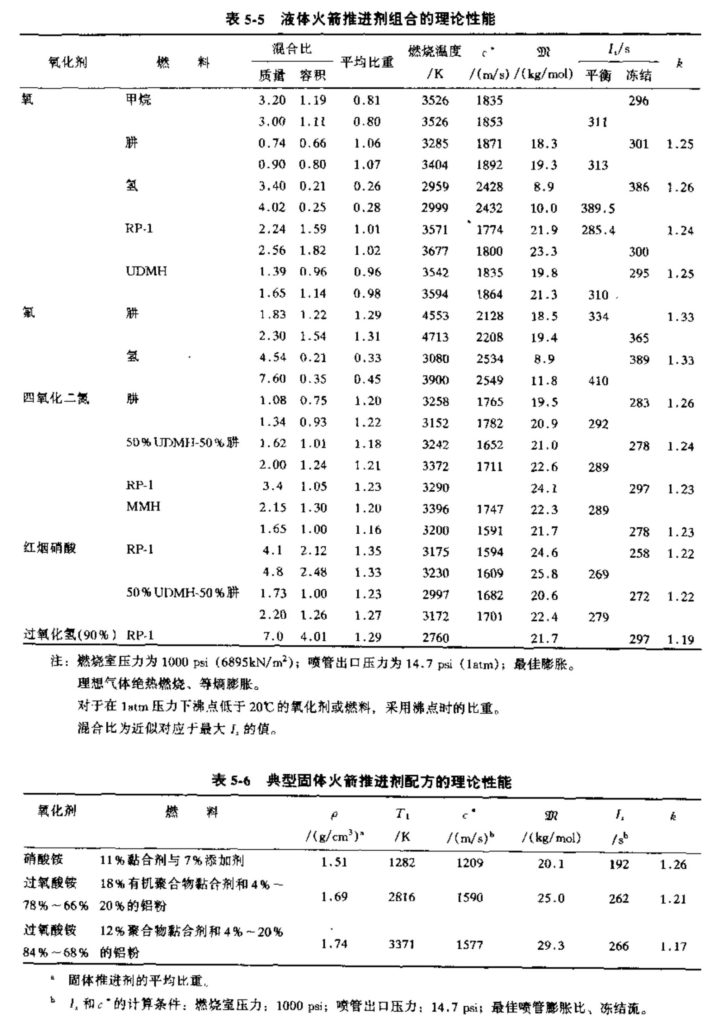
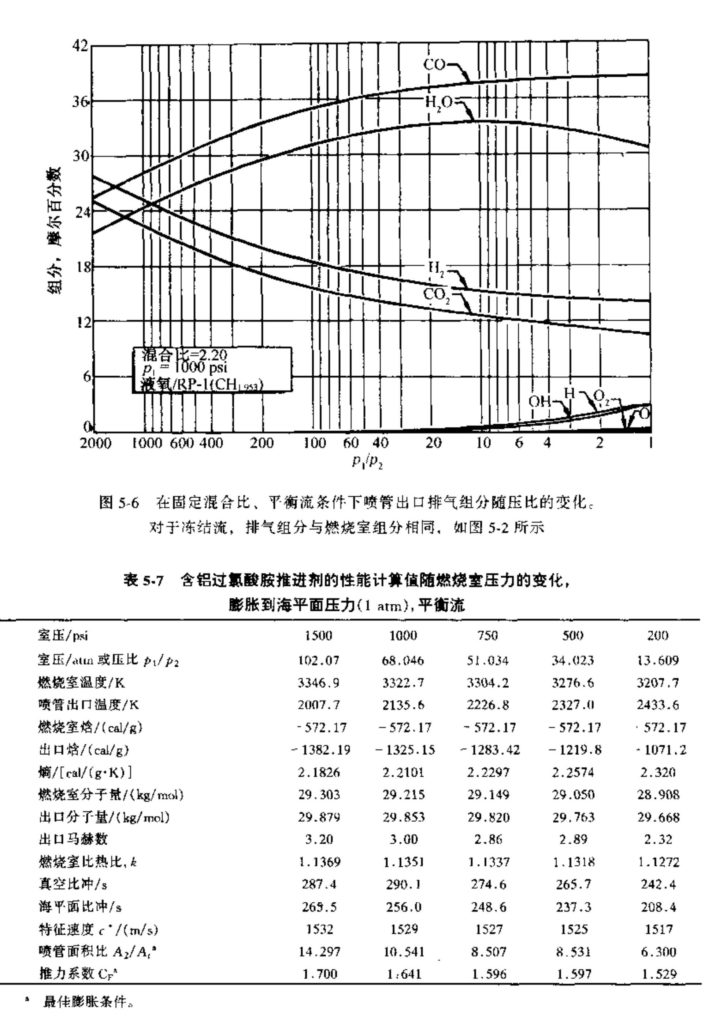
表5-7至5-9列出了一特定固体推进剂的计算数据(取自文献),这些数据表明了性能或燃气组分的典型变化。这种特定的推进剂由60%的过氯酸铵(NH4ClO3)、20%的纯铝粉和20%的有机聚合物(化学组分为\({{\text{C}}_{\text{3}\text{.1}}}\text{O}{{\text{N}}_{\text{0}\text{.84}}}{{\text{H}}_{\text{5}\text{.8}}}\))组成。表5-7给出了一些性能参数随燃烧室压力(膨胀到出口大气压)的变化。所列出的面积比为平衡流条件下该膨胀的最佳值。出口焓值、岀口熵值、推力系数和比冲也根据平衡流条件得出。特征速度C*和燃烧室分子量只与燃烧室状态有关。表5-8给岀了气体组分随燃烧室压力的变化。某些反应产物处于液相,如Al2O3。表5-9给出了在一定的燃烧室压力下、平衡流条件下的喷管出口特性和气体组分随出口压力或压比的变化。表5-9还给岀了气体在喷管内膨胀时其组分是如何变化的,以及在燃烧室内存在的几种组分是如何在喷管出口消失的。这三个表格给出了通过计算机得到的理论计算结果。由于反应物和反应产物的一些热力学特性数据的原因,根据计算机得到的这五个重要的曲线图不敢保证有很高的精度。在分析这种固体推进剂的化学成分时,除了考虑主要的燃烧产物组分外,还要考虑约76种次要的反应产物,例如CN、CH、CC1、Cl、NO等等。它们的摩尔分数计算值很小,因此忽略掉了,在表5-8或表5-9中没有列出。
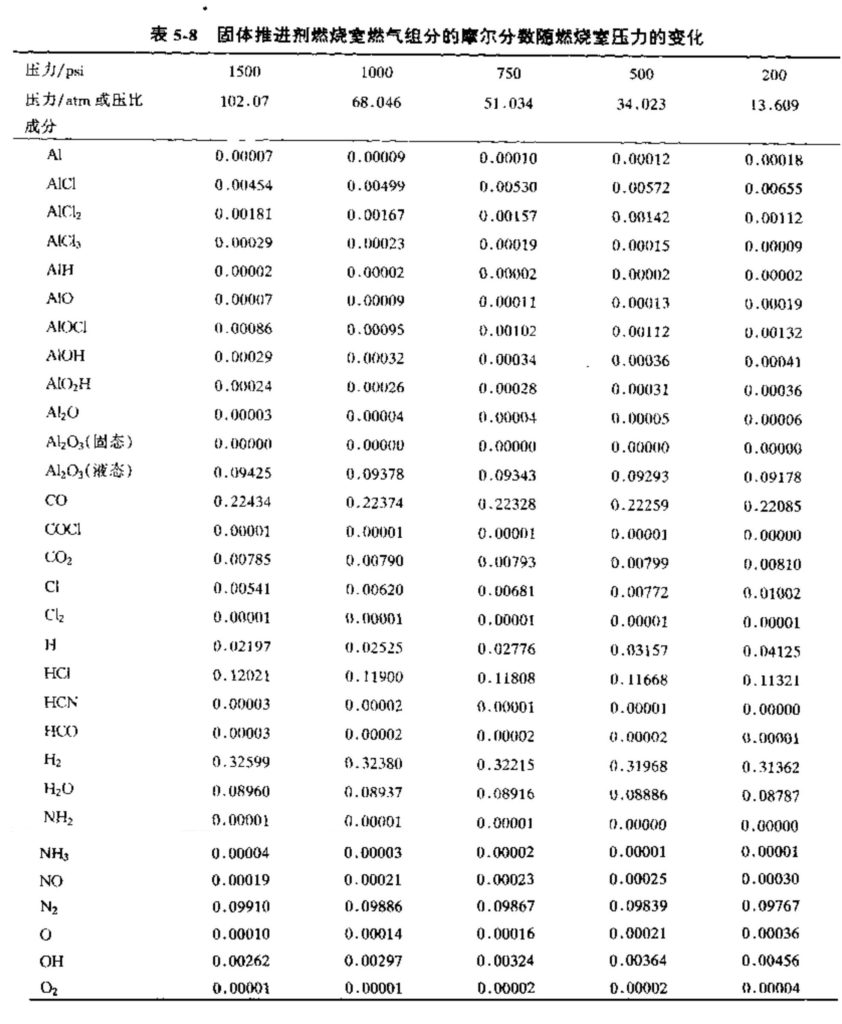
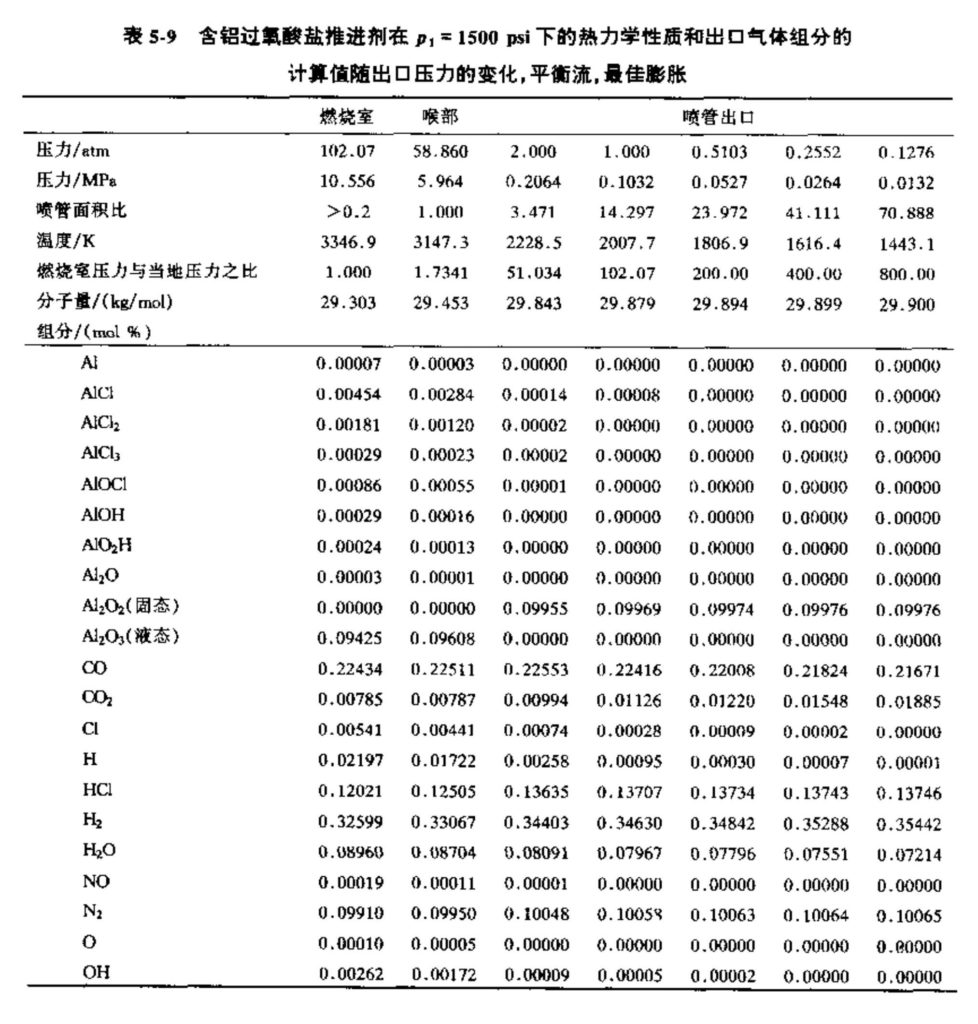
这类计算对于估算特定燃烧室压力和喷管出口压力的性能(Is、c*、CF、ε等)是很有用的,而气体组分数据(如前面图、表中给岀的)有助于更详细地估算其他一些设计参数,如用于传热分析的气膜特性、推力室内外火焰的辐射特征以及燃气的声学特性等。有关固液混合推进剂的性能计算数据将在第十五章作简要介绍。
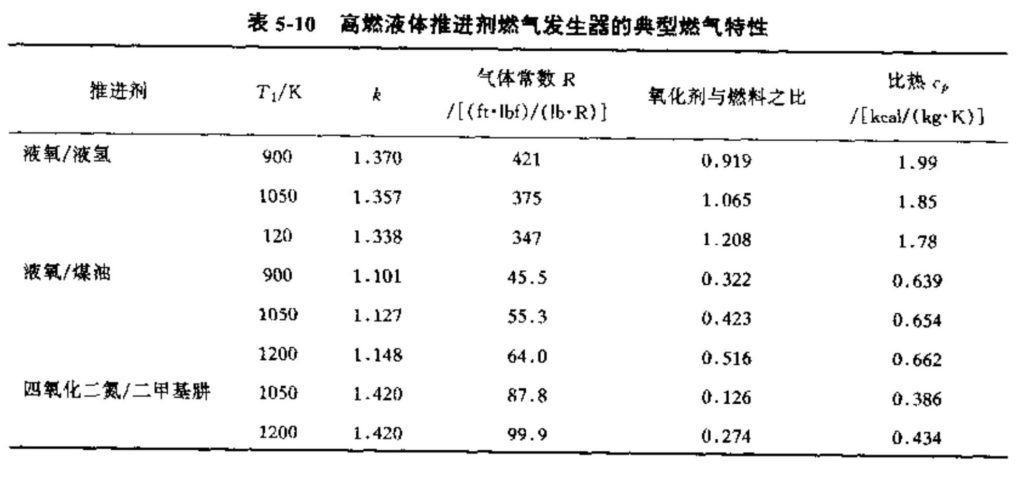
在燃气发生器或分级燃烧循环发动机(在6.5节中解释)的预燃室中(参见10.5节),燃气温度要足够低,以免损坏涡轮叶片。一般来说,燃烧反应气体的温度在900〜1200 K之间,比推力室燃气温度(2900〜3600 K)低得多。本章的热化学分析方法也可用于燃气发生器,其结果(如燃气温度T1、比热Cp、比热比k或组分)可用于计算涡轮进口状态或涡轮功率。表5-10列岀了一个例子,其室压为1000 psi。这里有些气体组分(如原子氧或氢氧基)将不存在。通常需要釆用实际气体性质,因为有些气体在这样的温度下不再具有理想气体的性质。
习题
1. 试叙述比冲在特定的氧化剂与燃料的混合比下达到最大值的物理和化学原因。
2.试解释表5-8中单原子氢和单原子氧的相对比例为何在不同的燃烧室压力和出口压力下变化如此明显?
3.本章给出了液氧与RP-1烃类燃料的一些性能曲线。由于操作失误,在装运低温氧化剂时至少混入了15%的液氮。试预计在既定的燃烧室和喷管状态以及最佳混合比下试验性能和排气组分的大致变化趋势。
4.一理想气体混合物含3 kg一氧化碳和1.5 kg氮,压力为0.1 MPa,温度为298.15 K。利用表5-1,试求(a)混合物的等效分子量;(b)气体常数;(c)比热比;(d)分压;(e)密度。
答案:(a) 28; (b) 297; (c) 1.40; (d) 0.0666 和 0.0333MPa; (e) 1.97o
5.利用表5-2的资料,作出一氧化碳(CO)的比热比随温度的变化曲线,并注意该曲线的变化趋势。它也是其他双原子气体的典型的温度特性。
答案:3500 K时k=1.28, 2000 K时k=1.30,500 K时k=1.39。
6.试将表5-5中的氧/氢和四氧化二氮/肼的数据改为真空工作时的性能数据并列表。假设表中数据相当于设计状态。
7.本章中的图示出了液氧与RP-1(一种煤油类物质)燃烧的若干参数和气体组分。对于2.0的混合比,试利用气体组分证实图5-1中的燃烧室分子量和比冲(喷管内为冻结流)。